
科目: 来源: 题型:
在容积相同的密闭容器中,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g)
 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
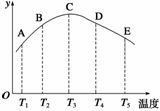
(1)A、B、C、D、E五点中,肯定未达平衡的点是
________________________________________________________________________。
(2)此可逆反应的正反应是__________热反应。
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如图表示298.15 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
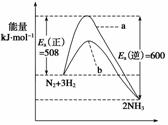
(1)若反应中生成2 mol氨,则反应________(填“吸热”或“放热”)________kJ。
(2)在图中曲线________(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____________________________________________________________
________________________________________________________________________。
(3)目前合成氨工业广泛采用的反应条件500℃、20 MPa~50 MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是
________________________________________________________________________。
A.降低反应温度,让反应向着有利于氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
查看答案和解析>>
科目: 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
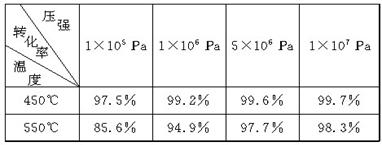
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(3) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
对于合成氨的反应,使用催化剂和施加高压,下列叙述中,正确的是( )
A.都能提高反应速率,都对化学平衡状态无影响
B.都对化学平衡状态有影响,都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有压强对化学平衡状态有影响
D.催化剂能缩短反应达到平衡状态所用的时间,而压强无此作用
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。若反应前后压强不变,则反应后缩小的气体体积与原反应物体积的比值为( )
A.1∶5 B.1∶4 C.1∶3 D.1∶2
查看答案和解析>>
科目: 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图: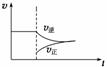
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目: 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目: 来源: 题型:
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y===2Z,如图所示是该反应中X的物质的量随时间变化的曲线。
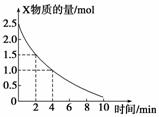
(1)分别求出2 min内和4 min内的平均速率。
(2)从(1)中数据可以得出什么结论?
查看答案和解析>>
科目: 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)
 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于m C.在m~2m之间 D.等于2m E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时各物质的体积分数与上述甲容器中达到平衡时相同,则起始应加入______mol N2和________mol H2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com