
科目: 来源: 题型:
NH3·H2O在水溶液中的电离方程式为_____________________________________________,
其电离常数表达式为_____________________________________________________________。
只改变下列一种条件:
①升高温度 ②加水稀释 ③加少量NaOH(s) ④通少量HCl(g) ⑤加入NH4Cl(s) ⑥加入Na2CO3(s)
其中能实现下列要求的是:
(1)使电离平衡正向移动的有________。
(2)使c(NH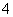 )减小的有________。
)减小的有________。
(3)使c(H+)增大的有________。
(4)使平衡常数Kb增大的有________。
查看答案和解析>>
科目: 来源: 题型:
我国有丰富的锆英石资源,其主要成分是ZrSiO4,还含有Al2O3、SiO2、Fe2O3等杂质,生产锆的流程之一如下:
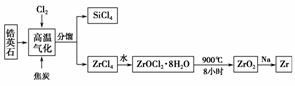
已知:锆(Zr)合金是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。
(1)上述流程中高温气化的反应是氧化还原反应(碳转化成CO),其中氧化剂是________,转移1.204×1024个电子时,生成SiCl4________g。
(2)写出ZrCl4与水反应的化学方程式:______________________,写出ZrOCl2·8H2O在900℃条件下分解的化学方程式:____________________________________。
3下列关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 。
A.1 nm=10-10 m
B.锆合金的硬度比纯锆要高,C.二氧化锆纳米陶瓷是新型无机非金属材料
4一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 填“正”或“负”极移动。电池的负极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
软锰矿是制备二氧化锰的原料,软锰矿中含有二氧化硅、氧化铜、氧化铁、氧化铝、氧化锌等杂质。工业上以软锰矿为原料制备高纯二氧化锰的工艺流程图如下:
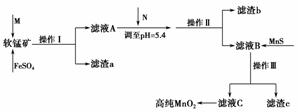
(1)酸性条件下,FeSO4将MnO2还原为MnSO4,那么加入的酸M为________,该反应的离子方程式为______________________________。
(2)制备二氧化锰工艺流程中涉及的阳离子以氢氧化物的形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 10.4 |
由流程图信息和表格中数据可知滤渣b的主要成分是________(填化学式)。调节溶液pH=5.4需加入试剂N,N可以是________。
a.CO2 b.稀硫酸 c.NH3 d.氨水
(3)部分硫化物的溶度积常数(Ksp)如下表:
| 硫化物 | CuS | ZnS | MnS | FeS |
| Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由表格中的数据推知流程图中向滤液B中加入MnS的作用是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
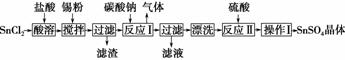
硫酸亚锡(SnSO4)可用于镀锡工业。某小组设计SnSO4制备路线为
查阅资料:
Ⅰ.锡在酸性溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)锡原子的核电荷数为50,与碳元素同处 ⅣA族,锡位于周期表的第________周期。
(2)操作Ⅰ是 ________、过滤和洗涤等。
(3)溶解SnCl2粉末时需加浓盐酸,原因为__________________________________________________________。
(4)加入Sn粉的作用为①调节溶液pH,②__________________________________________________________。
(5)反应Ⅰ所得沉淀是SnO,其化学反应方程式:__________________________________________________________。
(6)酸性条件下,SnSO4与双氧水反应的离子方程式:__________________________________________________________。
(7)该小组通过下列方法可测定该锡粉的纯度:
①将试样溶于盐酸,反应为Sn+2HCl===SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,再计算锡粉的纯度,请配平反应:
FeCl2+____K2Cr2O7+____HCl===____FeCl3+____KCl+____CrCl3+____
查看答案和解析>>
科目: 来源: 题型:
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑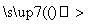
 溶液A
溶液A
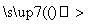
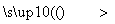 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是__________________________________________________________
________;证明溶液A中不含Fe3+的最佳试剂是________(填字母序号)。
a.酚酞溶液 B.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、________、过滤。
(2)浓度均为0.1 mol·L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH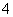 )前者大于后者,原因是_________________________________________________。
)前者大于后者,原因是_________________________________________________。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平________(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示):a接________;________接________。
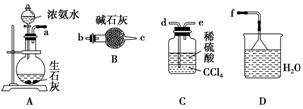
(5)将装置C中两种液体分离开的操作名称是________。装置D的作用是________________________________。
查看答案和解析>>
科目: 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6- 2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低, 其原因是______________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是__________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K,沸点为588 K。工业上制备无水FeCl3的一种工艺流程如下:

(1)氯化铁能用作水处理剂的原因是__________________________________________________________
(用必要的文字和化学方程式说明)。
(2)吸收塔中吸收剂X是________________________,有关反应的离子方程式是________________________。
(3)温度超过673 K时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________________。
(4)从副产物FeCl3溶液中获得FeCl3·6H2O的方法是__________________________________________________________。
(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是__________________________(用反应式表示并简述操作要点)。
查看答案和解析>>
科目: 来源: 题型:
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中,Br2与Na2SO3反应的离子方程式:__________________________________________________________。
(2)反应后,溶液含有SO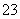 、SO
、SO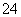 、Br-、OH-等阴离子,下表是某同学鉴定其中SO
、Br-、OH-等阴离子,下表是某同学鉴定其中SO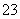 、SO
、SO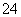 和Br-的实验报告,请完成未填完的部分。
和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1盐酸;1 mol·L-1H2SO4溶液;1 mol·L-1BaCl2溶液;1 mol·L-1Ba(NO3)2溶液;CCl4、新制饱和氯水、品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管中,加入过量的2 mol·L-1盐酸,再滴加适量1 mol·L-1BaCl2溶液 | 有白色沉淀生成,证明待测液中含SO |
| 步骤② | ||
| 步骤③ |
(3)为测定上述样品的纯度,该同学取10.0 g试样,配成250 mL溶液,取25.00 mL所配溶液,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点。离子反应为2MnO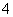 +5SO
+5SO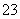 +6H+===2Mn2++5SO
+6H+===2Mn2++5SO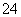 +3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
+3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
①该试样中Na2SO3的质量分数为________(结果保留3位有效数字);
②操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果________(填“偏高”、“偏低”或“没有影响”)。
查看答案和解析>>
科目: 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
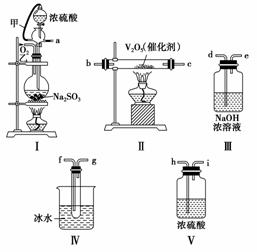
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。
制备气体的实验装置有(可重复选用):
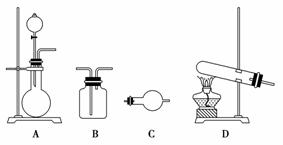
实验药品有:a.MnO2(s) b.浓盐酸 c.浓氨水 d.KClO3(s) e.碱石灰
f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号),A中发生反应的化学方程式为__________________________________________________________。
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是________,若氨气量较多,则瓶内会出现大量白烟,该白烟为__________________________。
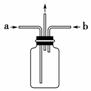
(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为__________________________________________________________
__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com