
科目: 来源: 题型:
室温时冰醋酸加水稀释过程中导电能力的变化如图所示。溶液的导电性体现了溶液中离子浓度大小。一般来说,溶液导电能力越强,离子浓度越大。
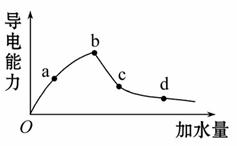
(1)图中O点[H+]=________mol·L-1。
(2)a、b、c、d四点中溶液的[H+]大小顺序为____________。电离程度大小顺序为______。电离平衡常数大小顺序为__________。(用“>”“=”或“<”来表示)
(3)若要使c点溶液中[CH3COO-]增大,而又不产生气体,则下列措施中可选择
_______ _。
_。
A.加水 B.加热
C.加锌粒 D.加固体NaOH
E.加很稀的 NaOH溶液 F.加固体CH3COON
NaOH溶液 F.加固体CH3COON a
a
(4)设d点醋酸溶液的浓度为c mol·L-1,此温度下醋酸的电离常数为Ka mol·L-1,达到平衡时醋酸分子浓度可近似为c mol·L-1,求平衡时溶液的pH(用Ka和c表示)。
查看答案和解析>>
科目: 来源: 题型:
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 mol,下列叙述错误的是( )
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
B。CH3COOH属于弱酸,体积相同的两种溶液中,由n(Cl-)=
查看答案和解析>>
科目: 来源: 题型:
当CH3COOH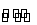 H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
A.CH3COONa B.NH3·H2O C.HCl D.H2O
查看答案和解析>>
科目: 来源: 题型:
在0.1 mol·L-1 CH3COOH溶液中存在电离平衡:CH3COOH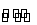 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
A.因为电离是吸热的,所以温度越高,同一弱电解质的电离平衡常数越小
B.弱电解质的电 离平衡常数只与弱电解质的本性及外界温度有关
离平衡常数只与弱电解质的本性及外界温度有关
C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱
D.多元弱酸的各级电离常数相同
查看答案和解析>>
科目: 来源: 题型:
将100 mL 6 mol·L-1的HCl与过量Zn粉反应,在一定温度下,为了减缓反应速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
A.Na2CO3固体 B.水
C.CH3COONa固体 D.(NH4)2SO4固体
查看答案和解析>>
科目: 来源: 题型:
下列的各种叙述中正确的是( )
A.任何酸都有电离平衡常数
B.任何条件下,酸的电离平衡常数都不变
C.多元弱酸各步电离平衡常数相互关系为Ka1<Ka2<Ka3
D.KW并不是水的电离平衡常数
查看答案和解析>>
科目: 来源: 题型:
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
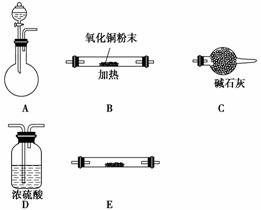
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
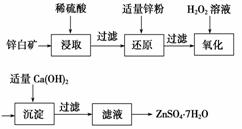
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
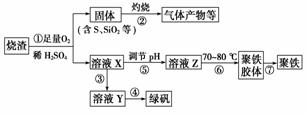
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液
c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________。
(3)过程③中,需加入的物质是______________;反应的化学方程式为________________________。用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有__________。
(5)过程⑤调节pH,最好选用下列试剂中的________(填选项序号)。
a.稀硫酸 b.CaCO3
c.NaOH溶液 d.Fe2O3
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com