
科目: 来源: 题型:
完成下列离子方程式:
(1)钠与水反应:_______________________________________________________________。
(2)氯气通入水中:_____________________________________________________________。
(3)向氢氧化钠溶液中通入少量CO2:
________________________________________________________________________。
(4)碳酸钙中滴入醋酸溶液:
________________________________________________________________________。
(5)铝片投入氢氧化钠溶液:
________________________________________________________________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:
________________________________________________________________________。
(7)FeCl3溶液与Cu反应:
________________________________________________________________________。
(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:
________________________________________________________________________。
(9)实验室用MnO2与浓盐酸制取Cl2:
________________________________________________________________________。
(10)NO2溶于水:_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
常见离子共存情况剖析
| 常见离子组合 | 共存情况 | 原因 |
| (1)Ba2+、Ca2+与SO | ||
| CO | ||
| (2)Mg2+与SO | ||
| (3)OH-与NH | ||
| (4)OH-与Mg2+、Al3+、Fe2+ | ||
| (5)H+与CH3COO-、ClO-、 | ||
| HCO | ||
| (6)Fe3+、Al3+与CO | ||
| HCO | ||
| (7)NO | ||
| (8)Fe3+与S2-、I- | ||
| (9)MnO | ||
| (10)NH |
查看答案和解析>>
科目: 来源: 题型:
正误判断,正确的打“√”,错误的打“×”
(1)NH3、SO2的水溶液均导电,所以NH3、SO2均属于电解质( )
(2)强电解质饱和溶液一定比弱电解质饱和溶液的导电性强( )
(3)NaCl溶液能导电,故NaCl溶液为电解质( )
(4)Fe、Cu、Ag熔化能导电,故Fe、Cu、Ag为电解质( )
(5)H2S溶于水的电离方程式为
H2SH++HS-,HS-H++S2-( )
(6)硫酸氢钠溶于水的电离方程式为
NaHSO4Na++H++SO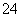 ( )
( )
查看答案和解析>>
科目: 来源: 题型:
乙炔是有机合成工业的一种重要原料。工业上曾用CaC2与水反应生成乙炔。
⑴CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ,1mol O22+中含有的π键数目为 。
⑵将乙炔通入[Cu(NH3)2]Cl溶液中生成红棕色沉淀Cu2C2。Cu+简写的核外电子排布式为 。
⑶乙炔与HCN反应可得到丙烯腈(CH2=CH—C≡N), 丙烯腈分子中碳原子轨道的杂化类型是 ;分子中处于同一直线上原子数目最多有 个。
⑷CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中哑铃形的C22-的存在,使晶胞沿一个方向拉长, CaC2晶体中一个Ca2+周围距离最近的C22-数目为 。

查看答案和解析>>
科目: 来源: 题型:
某实验小组的同学对电化学原理进行了一系列探究活动
⑴如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。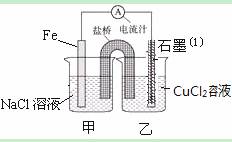
⑵用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
⑶如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨⑴为 极(填 “正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。

查看答案和解析>>
科目: 来源: 题型:
按要求回答下列问题:
⑴常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是 (填字母)
A.溶液中导电粒子的数目将减少 B.由水电离的c(H+)浓度将减小
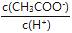
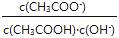
C.溶液中不变 D.溶液中 将减小
E.醋酸的电离程度将增大,c(H+)也增大
⑵①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2= (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是 (填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
⑶常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①写出向NaClO溶液中通入少量CO2的离子方程式 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是 (填字母)
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)=
(填准确数值)。
⑷已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于 。
查看答案和解析>>
科目: 来源: 题型:
⑴已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)== 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式 ,该反应的化学平衡常数的表达式K= (用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为: 。该电池使用过程中,正极附近溶液的pH将 (填“升高”、“降低”或“不变”)。
⑵已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有 (填字母)
A.及时移出氨 B.升高温度 C.使用催化剂 D.循环利用和不断补充N2
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为 。
查看答案和解析>>
科目: 来源: 题型:
有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为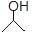 。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为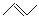 。
。
⑴CH3CH=CHCH3的名称为 ,其所含官能团的结构式为 ,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为 。
⑵完成下列反应方程式,产物用键线式表示: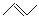 +Br2→ ,反应类型为 反应。
+Br2→ ,反应类型为 反应。
⑶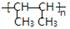 是一种加聚产物,则其单体的结构简式为 ,其链节为
是一种加聚产物,则其单体的结构简式为 ,其链节为
。
⑷写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式
。(任写一种)
查看答案和解析>>
科目: 来源: 题型:
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)  xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是
xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是
A.纵坐标可能表示C的产率
B.纵坐标一定可以表示混合气体平均摩尔质量
C.若p1>p2,则x=1或2
D.x的取值与p1、p2的相对大小有关
查看答案和解析>>
科目: 来源: 题型:
0.5mol某烃与1molHCl在一定条件下恰好完全加成,生成物再在光照下与Cl2发生取代反应,氢原子恰好全部被取代消耗Cl2 3mol,则该烃的分子式为
A.C3H6 B.C4H6 C.C3H4 D.C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com