
科目: 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目: 来源: 题型:
设nA为阿伏加德罗常数的数值。下列说法正确的是( )
A.1 mol甲苯含有6nA个C—H键
B.18 g H2O含有10nA个质子
C.标准状况下,22.4 L氨水含有nA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成nA个SO2分子
查看答案和解析>>
科目: 来源: 题型:
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):

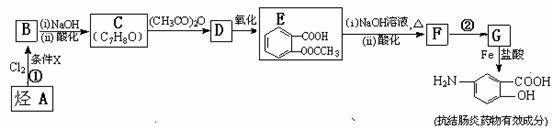
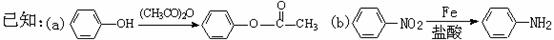
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。 ②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
A.水溶性比苯酚好,密度比苯酚的大 B.能发生消去反应
C.能发生聚合反应 D.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出所有符合下列条件的E的同分异构体的结构简式: 。
a.与F具有相同的官能团 b.苯环上的一硝基取代产物有两种
(6)已知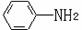 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物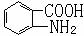 的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
查看答案和解析>>
科目: 来源: 题型:
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
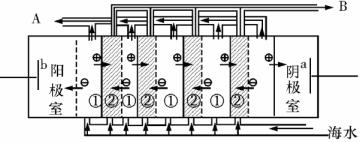
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有
ⅱ上图中虚线部分表示 离子交换膜。 淡水从 (A或B) 排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
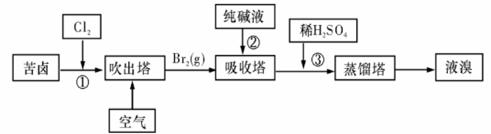
ⅰ写出反应③的离子方程式为: 。
ⅱ通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
ⅲ向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
。
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、遇酸均易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
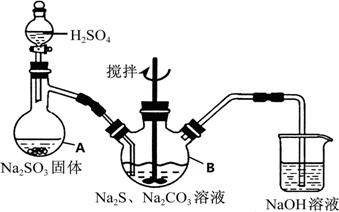
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地
通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)写出仪器A的名称 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式
。
(4)最后得到的产品中可能含有Na2SO4杂质。请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
。
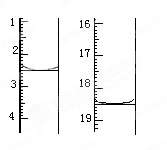 (5)测定产品纯度
(5)测定产品纯度
准确称取1.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O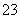 +I2===S4O
+I2===S4O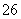 +2I-。滴定起始和终点的液面位置如图:
+2I-。滴定起始和终点的液面位置如图:
则消耗碘的标准溶液体积为_______mL。产品的纯度为
%。
(6)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO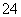 ,该反应的离子方程式为______________________________。
,该反应的离子方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
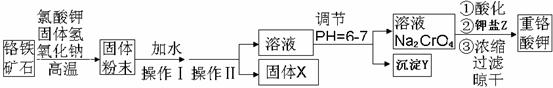
重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有 。铁在周期表的位置是 。
(2)操作Ⅱ的名称是 。
(3)固体X的主要成分是___________,沉淀Y的主要成分是 。
(4)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)________,
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸钾 D.次氯酸和次氯酸钾
酸化反应的离子方程式为 。
(5)FeO·Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)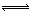 2ClNO(g) ∆H1 < 0 其平衡常数为K1
2ClNO(g) ∆H1 < 0 其平衡常数为K1
b、2NO2(g)+NaCl(s)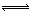 NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)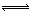 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
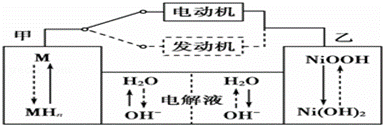
其总反应式为H2+2NiOOH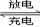 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
查看答案和解析>>
科目: 来源: 题型:
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液
反应,消耗盐酸体积Vb=Vc
查看答案和解析>>
科目: 来源: 题型:
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B.若以甲烷为燃料气时负极极反应式:
CH4+5O2--8e-=CO32-+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为
O2+4e-+2CO2===2CO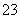
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com