
科目: 来源: 题型:
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4Ps,红)+5O2g)===2P2O5s) ΔH1
②4Ps,白)+5O2g)===2P2O5s) ΔH2
则ΔH1与ΔH2的关系正确的是 )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4s,白磷)+5O2g)===P4O10s)
ΔH1=-2 983.2 kJ·mol-1
Ps,红磷)+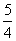 O2g)===
O2g)===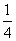 P4O10s)
P4O10s)
ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为
____________________________________________________。
2)已知298 K时白磷不完全燃烧的热化学方程式为P4s,白磷)+3O2g)===P4O6s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
查看答案和解析>>
科目: 来源: 题型:
已知在常温常压下:
①2CH3OHl)+3O2g)===2CO2g)+4H2Og)
ΔH1=-1 275.6 kJ·mol-1
②2COg)+O2g)===2CO2g)
ΔH2=-566.0 kJ·mol-1
③H2Og)===H2Ol) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________________________________________
____________________________________________________。
2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2g)+O2g)===2NOg)
ΔH=+180.5 kJ·mol-1
2H2g)+O2g)===2H2Ol)
ΔH=-571.6 kJ·mol-1
则H2g)与NOg)反应生成N2g)和H2Ol)的热化学方程式为________________________________________________________
____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知:
甲醇脱水反应
2CH3OHg)===CH3OCH3g)+H2Og)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OHg)===C2H4g)+2H2Og)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OHg)===CH3OCH3g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4g)+H2Og)===C2H5OHg)的ΔH=________kJ·mol-1。
2)[2012·广东理综,314)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Lis)+I2s)===2Lis) ΔH
已知:4Lis)+O2g)===2Li2Os) ΔH1
4LiIs)+O2g)===2I2s)+2Li2Os) ΔH2
则电池反应的ΔH=________。
查看答案和解析>>
科目: 来源: 题型:
已知:
2Zns)+O2g)===2ZnOs) ΔH=-701.0 kJ·mol-1
2Hgl)+O2g)===2HgOs) ΔH=-181.6 kJ·mol-1
则反应Zns)+HgOs)===ZnOs)+Hgl)的ΔH为 )。
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是双选) )。
A.已知在T ℃时,反应2Ag)+Bg)3Cg) ΔH>0的正反应速率表示为v,若降低温度,正反应速率减小,逆反应速率增大
B.在恒容容器中发生反应N2g)+3H2g)2NH3g),若往容器中充入He,正逆反应的速率均不变
C.当一定量的锌粉和4 mol·L-1的过量盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向容器中加入一些水或硝酸钠溶液
D.对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
查看答案和解析>>
科目: 来源: 题型:
对于反应4A+2B3C,下列说法中正确的是 )。
A.某温度时,化学反应速率无论用A、B、C中任何物质表示,其数值都相同
B.其他条件不变时,降低温度,化学反应速率减小
C.其他条件不变时,增大压强,化学反应速率一定加快
D.若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目: 来源: 题型:
在容积固定的容器中发生反应:COg)+2H2g)CH3OHg) ΔH<0,各物质的浓度如表所示:
| 浓度 时间 | cCO)/mol·L-1 | cH2)/mol·L-1 | cCH3OH)/mol·L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2 min | 0.6 | x | 0.2 |
| 4 min | 0.3 | 0.6 | 0.5 |
| 6 min | 0.3 | 0.6 | 0.5 |
下列说法不正确的是 )。
A.2~4 min内用H2表示的平均反应速率为0.3 mol·L-1·min-1
B.达到平衡时,CO的转化率为62.5%
C.反应在第2 min时改变了条件,可能是加入了催化剂
D.反应在第2 min时改变了条件,可能是增加了H2的浓度
查看答案和解析>>
科目: 来源: 题型:
反应Ag)+3Bg)===2Cg)+2Dg)在四种不同情况下的反应速率分别为
①vA)=0.45 mol·L-1·min-1
②vB)=0.6 mol·L-1·s-1
③vC)=0.4 mol·L-1·s-1
④vD)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是 )。
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
查看答案和解析>>
科目: 来源: 题型:
下图是某煤化工产业链的一部分,试运用所学知识,解决下列问题:
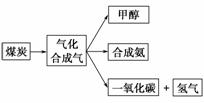
1)已知该产业链中某反应的平衡常数表达式为K=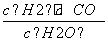 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
____________________________________________________。
2)合成甲醇的主要反应是2H2g)+COg)CH3OHg) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率vH2)=________。
②比较此时正、逆反应速率的大小:v正________v逆填“>”、“<”或“=”)。
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡 ________填“逆向”、“正向”或“不”)移动,平衡常数K________填“增大”、“减小”或“不变”)。
3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2g)+O2g)===2NOg) ΔH=+180.8 kJ·mol-1,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是________填字母序号)。
| 反应 | 大气固氮 | 工业固氮温度/℃ | ||||
| 27 | 2 000 | 25 | 350 | 400 | 450 | |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com