
科目: 来源: 题型:
以下自发反应可用能量判据来解释的是( )
A.硝酸铵自发地溶于水
B.2N2O5(g)===4NO2(g)+O2(g)
ΔH=56.7 kJ·mol-1
C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)
ΔH=74.9 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l)
ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
某反应:A===B+C在室温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是( )
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
查看答案和解析>>
科目: 来源: 题型:
在图(1)中A、B两个容器里,分别收集着两种不同的理想气体。若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
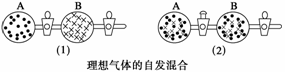
A.此过程是从混乱程度小向混乱程度大变化的过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程是从有序到无序,混乱度增大的过程
D.此过程是自发可逆的
查看答案和解析>>
科目: 来源: 题型:
下列对熵的理解不正确的是( )
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应
查看答案和解析>>
科目: 来源: 题型:
实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一个重要因素
D.焓变是决定反应是否具有自发性的唯一判据
查看答案和解析>>
科目: 来源: 题型:
1.下列说法正确的是( )
A.放热反应一定是自发进行的反应
B.吸热反应一定是非自发进行的反应
C.自发进行的反应一定容易发生
D.有些吸热反应也能自发进行
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2 反应生成 CH4和H2O的热化学方程式 。(3分)
已知: ① CO(g)+H2O(g)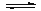 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g)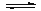 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g)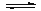 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
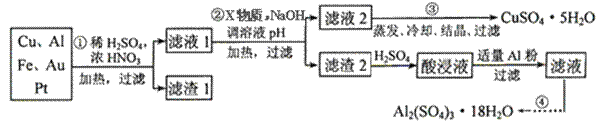
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。(2分)
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)(1分)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。(2分)
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________ (2分)
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在 (填仪器名称)中加热脱水。(1分)
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该
电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O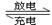 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为 (3分),每有1mol K2FeO4被还原,转移电子的物质的量为 (1分),充电时阳极反应式为
查看答案和解析>>
科目: 来源: 题型:
盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线如下:
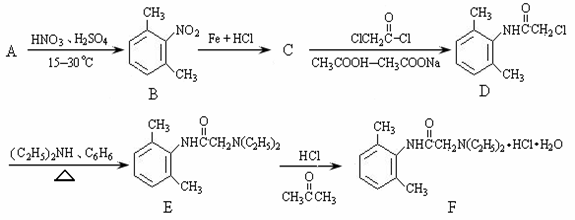
(1)B在核磁共振氢谱上有 种特征峰,D→E的反应类型是 。(每空2分)
(2)C的结构简式为 。(2分)
(3)写出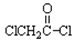 与足量的NaOH溶液共热充分反应的化学方程式:(3分)
与足量的NaOH溶液共热充分反应的化学方程式:(3分)
。
(4)B的同分异构体种类很多,符合以下条件的B的同分异构体共有 种。(3分)
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸钠溶液反应可放出CO2气体。
查看答案和解析>>
科目: 来源: 题型:
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为__________________(2分);
向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________ (2分)。
(2)请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱。
①提出假设:假设1:Fe2+还原性强于I-;假设2:_____________________________(1分)
②设计实验方案,写出实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤(6分) | 预期现象与结论(2分) |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再_________ __ | 现象:溶液变成黄色。结论:可能是生成了Fe3+、也可能是生成了I2。 |
| 步骤2:___________________________
|
|
(3)利用(2)②中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水,______________________________________________________。(3分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com