
科目: 来源: 题型:
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为______________。
(2)实验③中的现象为__________________。
(3)实验①、②中反应的离子方程式分别是________________、______________。
查看答案和解析>>
科目: 来源: 题型:
氮氧化合物是大气污染的重要因素,将NOx转化为无害物质是当前研究的重要课题。
(1)将NO2在适当的反应条件下变成无害的N2,必须要找到适合的物质G,G应为________(填写“氧化剂”或“还原剂”)。
(2)下式中X必须为无污染的物质,系数n可以为0。
NO2+G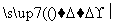 N2+H2O+nX(未配平的反应式)。
N2+H2O+nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(3)若G为天然气的主要成分,则X为____________,n=__________。
查看答案和解析>>
科目: 来源: 题型:
做实验时不小心沾在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅速褪去,其反应的离子方程式为
MnO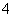 +H2C2O4+H+—→CO2↑+Mn2++
+H2C2O4+H+—→CO2↑+Mn2++
下列有关此反应的叙述正确的是( )
A.乙二酸中C显+2价
B.反应的离子方程式右侧方框内的产物是OH-
C.氧化剂和还原剂的化学计量数之比是5∶2
D.若有6 mol H+参加反应,则转移电子10 mol
查看答案和解析>>
科目: 来源: 题型:
某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO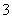 、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列判断中正确的是(双选)( )
、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列判断中正确的是(双选)( )
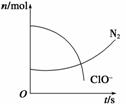
A.还原剂是CN-,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO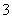
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.标准状况下若生成2.24 L N2,则转移1 mol电子
查看答案和解析>>
科目: 来源: 题型:
铋(Bi)位于元素周期表中ⅤA 族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
| 加入 溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验 现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目: 来源: 题型:
向KI溶液中逐滴加入少量CuSO4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析中不正确的是( )
A.充分反应后的溶液中无Cu2+存在
B.滴加CuSO4溶液时,每生成1 mol CuI会转移1 mol e-
C.根据上述实验现象可知:Cu2+比I2的氧化性强
D.通入SO2时发生反应的离子方程式为SO2+I2+2H2O===2HI+2H++SO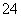
查看答案和解析>>
科目: 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
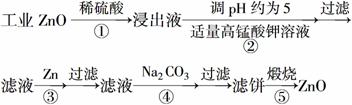
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
则:反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
查看答案和解析>>
科目: 来源: 题型:
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液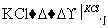 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ __________。
__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com