
科目: 来源: 题型:
已知723 K时,2SO2(g)+O2(g)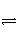
 2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
查看答案和解析>>
科目: 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g)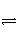
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)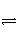
 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+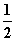 O2(g)
O2(g)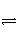
 SO3(g) ΔH=98.3 kJ·mol-1
SO3(g) ΔH=98.3 kJ·mol-1
D.SO2(g)+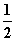 O2(g)
O2(g)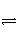
 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
今有如下三个热化学方程式:
H2(g)+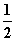 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+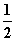 O2(g)===H2O(l) ΔH=b kJ·mol-1
O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目: 来源: 题型:
下列对化学反应热问题的说法正确的是( )
A.放热反应发生时不必加热
B.化学反应一定有能量变化
C.一般地说,吸热反应加热后才能发生
D.化学反应的热效应数值与参加反应的物质的多少无关
查看答案和解析>>
科目: 来源: 题型:
下列变化中,属于吸热过程的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.①②④
查看答案和解析>>
科目: 来源: 题型:
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)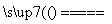 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+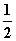 O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+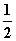 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
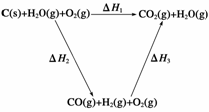
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________(填“甲”或“乙”);判断的理由是________________________________________________________________________
________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:________________________________________________________________________
________________________________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目: 来源: 题型:
根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1,C(石墨,s)+O2(g)===CO2(g)
ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
由此看来更稳定的碳的同素异形体为__________。若取金刚石和石墨的混合晶体共1 mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物质的量之比为_____________
_________(用含Q的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
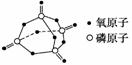
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
科目: 来源: 题型:
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1______ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1______ΔH2
(3)煤作为燃料有两种途径:
途径1——直接燃烧
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.44.2 kJ·mol-1
C.-330 kJ·mol-1 D.330 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com