
科目: 来源: 题型:
将2 mol X和2 mol Y充入2 L的密闭容器中发生如下反应:X(g)+3Y(g)  2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.2  mol·L-1
mol·L-1
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol·(L·min)-1
查看答案和解析>>
科目: 来源: 题型:
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
查看答案和解析>>
科目: 来源: 题型:
下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目: 来源: 题型:
已知反应2A(g)+B(g) C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
查看答案和解析>>
科目: 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)====2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)====2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例的空气,使部分H2S燃烧,其目的是___________________________ _______________________________;
_______________________________;
燃烧生成的SO2与H2S进一步反应,生成物在常温下均不是气体,写出该反应的化学方程式:_______________________________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图a所示。图中A、B表示的物质依次是________________________。
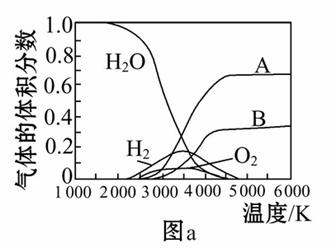
查看答案和解析>>
科目: 来源: 题型:
可燃冰中蕴藏着大量的甲烷,有望成为未来新能源。已知1 mol CH4气体完全燃烧生成CO2气体和液态H2O时放出的热量为890.3 kJ,当它不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4在n g O2中燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。
(1)写出表示甲烷燃烧热的热化学方程式。
(2)写出甲烷气体不完全燃烧的热化学方程式。
(3)计算n的值。
查看答案和解析>>
科目: 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
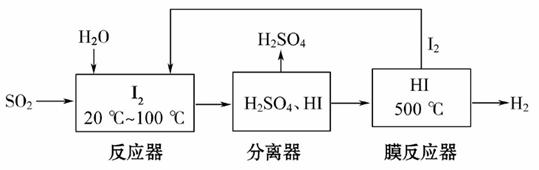
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为
________________________________________。
(2)该循环工艺过程的总反 应方程式为__________________________________。
应方程式为__________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是__________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
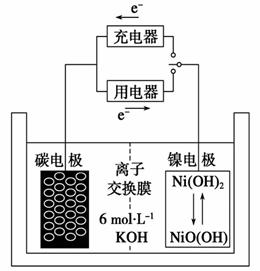
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。
电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe做电极的原因为_____________________________________________。
(2)在阴极附近溶液pH升高的原因是 (用电极反应解释) __________________。
溶液中同时生成的沉淀还有___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.C(s)+O2(g)====CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)====CO(g)+H2(g) ΔH=E2 ②
H2(g)+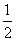 O2(g)====H2O(g) ΔH=E3 ③
O2(g)====H2O(g) ΔH=E3 ③
CO(g)+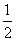 O2(g)====CO2(g) ΔH=E4 ④
O2(g)====CO2(g) ΔH=E4 ④
回答下列问题:
(1)与途径a相比途径b有较多的优点,即____________________________。
(2)上述四个热化学方程式中的反应__________________中ΔH>0。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是____________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为___________。
查看答案和解析>>
科目: 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
xMg+Mo3S4 MgxMo3S4
MgxMo3S4
在镁原电池放电时,下列说法错误的是( )
A.Mg2+向正极迁移
B.正极反应为Mo3S4+2xe-====Mo3S42x-
C.Mo3S4发生氧化反应
D.负极反应为xMg-2xe-====xMg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com