
科目: 来源: 题型:
下列各项中可说明HAc是弱电解质的是( )
A.0.1 mol·L-1HAc的pH>1
B.相同温度下,醋酸与强酸溶液的导电性比较
C.相同物质的量浓度、相同体积的醋酸和盐酸分别与足量的活泼金属反应时,消耗金属的量
D.pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液的酸碱性
查看答案和解析>>
科目: 来源: 题型:
下列溶液一定呈中性的是( )
A.[H+]=[OH-]=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊溶液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目: 来源: 题型:
(1)二氧化硫的催化氧化的过程如图所示:
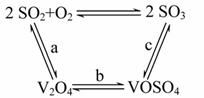
其中a、c二步的化学方程式可表示为____________
SO2+V2O5 SO3+V2O4
SO3+V2O4
4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
该反应的催化剂是__________(写化学式)。
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关 系如图所示:
系如图所示:
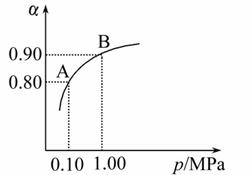
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。
2SO2+O2 在550 ℃时的平衡常数K=_________。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0 mol SO2和1.0 mol O2
(4)维持温度不变条件下使之发生如下反应:
2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:

试填写下列空格:
A容器达到平衡时所需的时间比B容器___________(填“短”或“长”);平衡时A容器中SO2的转化率 比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
查看答案和解析>>
科目: 来源: 题型:
光气(COCl2)在塑料、制革、制药 等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为____________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和
-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为______________;
(3)COCl2的分解反应为COCl2(g)====Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未表示出):
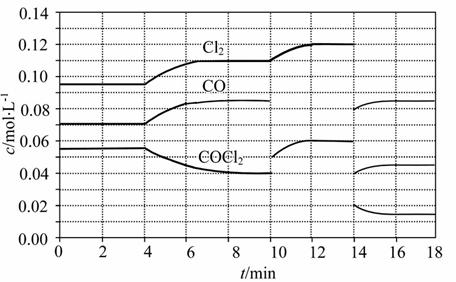
①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_____
T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________
___ mol·L-1;
④比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)_____v(15~16)(填“<”“>”或“=”),原因是______________
_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+ I2(g)
I2(g) 2HI(g)
2HI(g)
ΔH<0,反应中各物质的浓度随时间变化情况如图1:
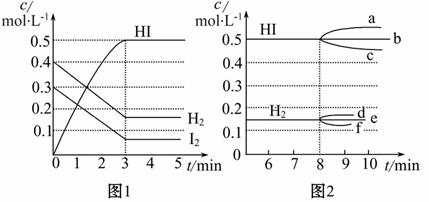
(1)该反应的化学平衡常数表达式为__________。
(2)根据图1数据,反应开始至达到平衡时,平均反应速率v(HI)为_______。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_________(填“增大”“减小”或“不变”),HI浓度的变化正确的是___________(用图2中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是_______(用图2中d~f的编号回答)。
查看答案和解析>>
科目: 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)  2NO2(g) (Ⅱ)
2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下 列示意图正确且能说明反应达到平衡状态的是__________。
列示意图正确且能说明反应达到平衡状态的是__________。
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ______mol·L-1·s-1。
查看答案和解析>>
科目: 来源: 题型:
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1 mol A和3 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和3 mol B且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是__________(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质的量为_______mol(用含字母a的代数式表示),此时C在反应混合气中的体积分数与原平衡相比___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
温度为T时,向2.0 L 恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)====PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
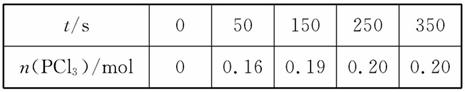
下列说法正确的是( )
A.反应在前50 s的平均速率
v(PCl3)=0.003 2 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol  PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com