
科目: 来源: 题型:
控制变量法在化学实验探究中运用较多,它是指在研究和解决问题的过程中,对影响事物变化规律的因素或条件加以人为控制,使其中的一些条件按照特定的要求发生或不发生变化,以便在研究过程中,找到事物变化发展的规律。根据因素和条件的性质,可分为实验变量(自变量)、反应变量(因变量)和无关变量。某研究小组用酸性KMnO4溶液与H2C2O4溶液反应中溶液紫色消失的方法,来研究浓度对化学反应速率的影响。下列实验有关变量控制的操作错误的是( )
A.为控制无关变量的影响,将实验温度均确定为25℃、酸性KMnO4溶液与H2C2O4溶液的体积均确定为4 mL,不使用催化剂
B.可选择浓度分别为0.05 mol·L-1、0.01 mol·L-1、0.001 mol·L-1的KMnO4酸性溶液和浓度均为0.001 mol·L-1的H2C2O4溶液反应,来操纵实验变量,进行对照实验
C.可将单位时间内反应所生成的CO2体积作为实验变量(自变量)进行本实验研究
D.该实验研究中的反应变量(因变量)是溶液紫色褪去所消耗的时间
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/ (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
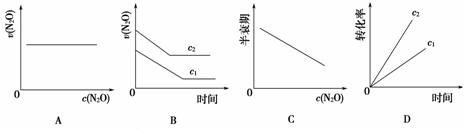
查看答案和解析>>
科目: 来源: 题型:
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
| 编号 | 纯锌粉质量 | 0.2 mol·L-1硫酸体积 | 温度 | 硫酸铜固体质量 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
查看答案和解析>>
科目: 来源: 题型:
已知:H2(g)+I2(g)2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
查看答案和解析>>
科目: 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果且可行的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目: 来源: 题型:
甲醇是人们开发利用的一种新能源,已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
③CH3OH(l)===CH3OH(g) ΔH3=+37.4 kJ·mol-1
(1)写出表示甲醇燃烧热的热化学方程式:__________________________________________________________
__________________________________________________________。
(2)H2的燃烧热为__________________________________________________________。
(3)二甲醚也是一种新型燃料,1 mol二甲醚蒸气完全燃烧生成CO2和液态水时放出1 455 kJ热量,若1 mol二甲醚和甲醇的混合气体完全燃烧生成CO2和液态水时共放出1 224.9 kJ热量,则混合气体中甲醇和二甲醚的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)CaO(s)+CO2(g) +SO2(g)
ΔH2=+210.5 kJ·mol-1
③ CO(g)1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)
(2)[2014·全国新课标Ⅰ,28(2)]已知:
甲醇脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OH(g)===CH3OCH3(g) ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。
(3)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为( )
A.247.3 kJ B.494.6 kJ
C.2.76×103 kJ D.5.52×103 kJ
查看答案和解析>>
科目: 来源: 题型:
已知:NaHCO3在水溶液中水解的热化学方程式为:NaHCO3(aq)+H2O(l)===H2CO3(aq)+NaOH(aq) ΔH=a kJ·mol-1;稀盐酸和稀NaOH的中和热为b kJ·mol-1。则等物质的量的NaHCO3(aq)与稀HCl(aq)反应的ΔH等于
( )
A.(a+b) kJ·mol-1 B.(a-b) kJ·mol-1
C.-(a-b) kJ·mol-1 D.-(a+b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com