
科目: 来源: 题型:
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:
(1)a、c均能与稀硫酸反应放出气体;
(2)b与d的硝酸盐反应,置换出单质d;
(3)c与强碱反应放出气体;
(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
|
| A. | Fe Cu Al Ag Mg |
|
| B. | Al Cu Mg Ag Fe |
|
| C. | Mg Cu Al Ag Fe |
|
| D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
|
| A. | 因HClO是弱酸,所以NaClO是弱电解质 |
|
| B. | 可用丁达尔效应区分溶液与胶体 |
|
| C. | 钠可以保存在煤油或四氯化碳中 |
|
| D. | 观察钠的焰色,要用到铂丝、氯化钠溶液和稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:
氯气用途十分广泛,可用于生产半导体材料硅,其生产的流程如下,下列说法不正确的是( )石英砂 粗硅
粗硅 四氯化硅
四氯化硅 纯硅.
纯硅.
|
| A. | ①③是置换反应,②是化合反应 |
|
| B. | 高温下,焦炭与氢气的还原性均强于硅 |
|
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
|
| D. | 如果焦炭不足,反应①会释放CO2气体 |
查看答案和解析>>
科目: 来源: 题型:
某化学实验小组的同学用下列仪器组装两套完全相同的装置,定量探究浓度对反应速率的影响。
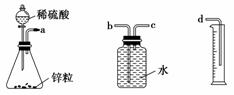
(1)为达到本实验的目的,其装置连接顺序为a连________,________连________。
(2)连接好装置后的下一步操作是__________________________________________________________。
(3)锥形瓶中发生反应的离子方程式为__________________________________________________________。
(4)两套装置的分液漏斗所装的试剂分别为1 mol·L-1硫酸和4 mol·L-1硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1 mol·L-1硫酸 | 10 mL | t1 | v1 |
| 4 mol·L-1硫酸 | 10 mL | t2 | v2 |
该小组同学通过实验得到的结果是:v1小于v2,其定量依据是________。
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol·L-1) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请在给定的坐标图中作出v(H2)-t的图像。
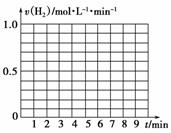
请解释0到4 min时该化学反应速率随时间变化的原因:__________________________________________________________
__________________________________________________________。
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方法有:__________________________________________________________
__________________________________________________________。(任写一种)
查看答案和解析>>
科目: 来源: 题型:
一定温度下向某容积固定的密闭容器中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
(1)Q1________Q(填“<”、“>”或“=”),由是__________________________________________________________
__________________________________________________________。
(2)A的转化率α=________(用含Q、Q1的代数式表示);平衡后,若加入少量物质D,A的转化率________(填“增大”、“减小”或“不变”)。
(3)反应达到平衡后,若升高温度,K________(填“增大”、“减小”或“不变”),混合气体的平均相对分子质量________(填“增大”、“减小”或“不变”)。
(4)维持温度和其他条件不变,若起始时向容器中加入的物质如下列四个选项,则反应达到平衡后放出的热量仍为Q1 kJ的是(稀有气体不参与反应)________(填序号)。
A.2 mol A、1 mol B、1 mol Ar
B.3 mol C、1 mol D
C.1 mol A、0.5 mol B、1.5 mol C、0.5 mol D
D.2 mol A、1 mol B、1 mol D
查看答案和解析>>
科目: 来源: 题型:
在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g)+O2(g)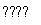 2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是(双选)( )
2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是(双选)( )
A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中气体的物质的量小于1.485 mol
查看答案和解析>>
科目: 来源: 题型:
某温度下,在体积为2 L的密闭容器中,充入1 mol 气体A和a mol气体B,发生如下反应:A(g)+B(g)2C(g)。5 min 后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如图所示。下列叙述正确的是(双选)( )
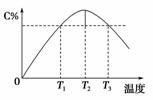
A.0~5 min,C物质的平均反应速率为0.12 mol·L-1·min-1
B.图中T1时正反应速率等于T3时正反应速率
C.该反应T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com