
科目: 来源: 题型:
某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO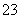 、SO
、SO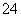 ,对该溶液进行下列实验,实验操作和现象如下表:
,对该溶液进行下列实验,实验操作和现象如下表:
| 步骤 | 操作 | 现象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4溶液,振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列结论正确的是( )
A.可能含有Cl-、SO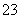 、SO
、SO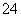 B.肯定没有Ba2+、Cl-、Br-
B.肯定没有Ba2+、Cl-、Br-
C.不能确定Na+、SO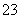 、SO
、SO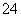 D.肯定含有Na+、Br-、SO
D.肯定含有Na+、Br-、SO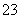
查看答案和解析>>
科目: 来源: 题型:
2013年12月12日,中国矿业报报道中国地质科学院矿产综合利用研究所认定石龙铜矿含铜品位高(含铜3.27%)。已知铜矿物以黄铜矿、斑铜矿和辉铜矿为主。黄铜矿(CuFeS2)既是制取铜及其化合物的主要原料,又可以制备硫及铁的化合物。请回答下列问题:
(1)冶炼铜的反应方程式为8CuFeS2+21O2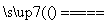 8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
(2)上述冶炼过程中产生大量二氧化硫,下列对其性质的描述中正确的是________(填序号)。
A.SO2既是氧化剂,又是还原剂
B.SO2是还原产物
C.SO2是形成酸雨的一种物质
D.SO2是氧化产物
(3)SO2的存在对CO2的检验会造成干扰,实验室常用酸性高锰酸钾溶液除去SO2,请写出该反应的化学方程式:
_______________________________________________________________。
(4)利用黄铜矿冶炼产生的炉渣(含FeO、Fe2O3、SiO2、Al2O3)可制备Fe2O3。方法为先用稀盐酸浸取炉渣,过滤;将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。用下列哪些试剂可以验证炉渣中含有FeO?________________(填序号)。其中发生氧化还原反应的离子方程式为____________________。
A.稀盐酸 B.稀硫酸 C.KSCN溶液
D.KMnO4溶液 E.NaOH溶液 F.碘水
查看答案和解析>>
科目: 来源: 题型:
作为世界卫生组织(WHO)推荐的Al级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)反应时,ClO2生成ClO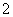 、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为________。
、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为________。
2亚氯酸根离子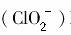 对人体不利。欲在弱碱性条件下将水中的
对人体不利。欲在弱碱性条件下将水中的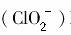 转化为Cl-除去,若该反应体系中的物质有:NaClO2、FeOH3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目。
转化为Cl-除去,若该反应体系中的物质有:NaClO2、FeOH3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目。

查看答案和解析>>
科目: 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果化学计量数是1,不再填写):
 (2)整个过程中的还原剂是________。
(2)整个过程中的还原剂是________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4 层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________________________________。
(4)加碘盐中含碘量为20 mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________ L(标准状况,保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
(1)某反应池发生“生物硝化”过程,利用O2将NH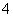 氧化成NO
氧化成NO ,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
 请完成上述离子方程式的配平。
请完成上述离子方程式的配平。
(2)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,若I2和KBr的化学计量数分别是8和1,请组成一个配平的化学方程式
________KBrO3+________+________H2SO4―→________+________+________+________+________H2O
查看答案和解析>>
科目: 来源: 题型:
H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________。
(2)[2014·全国新课标Ⅱ,27(2)(3)]①PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为____________________。
②PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_____________________________________________。
(2)[2013·广东理综,32(3)]完成煅烧过程中一个反应的化学方程式:________CuO+________Al2O3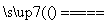 ________CuAlO2+________↑。
________CuAlO2+________↑。
查看答案和解析>>
科目: 来源: 题型:
在5.6 g Fe粉中加入过量的稀硫酸,待反应完全后,再加入1 mol·L-1 KNO3溶液25 mL,恰好反应完全。该反应的方程式为FeSO4+KNO3+H2SO4―→K2SO4+Fe2(SO4)3+NxOy+H2O(未配平),则对该反应的下列说法正确的是( )
A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
B.反应中氧化产物是N2O
C.反应过程中转移的电子为8 mol电子
D.氧化产物和还原产物的物质的量之比为1∶4
查看答案和解析>>
科目: 来源: 题型:
有Fe2+、NO 、Fe3+、NH
、Fe3+、NH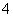 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1∶8
B.该反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO 发生氧化反应,转移8 mol e-
发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-===Fe3+
查看答案和解析>>
科目: 来源: 题型:
部分中学化学常见元素原子结构及性质如下表所示:
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的1/5 |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为______________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________________;
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显______性,N的结构式为______________________。
(4)B~F各元素原子半径由小到大的顺序是__________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com