
科目: 来源: 题型:
下列各组离子在指定环境中一定能大量共存的是( )
A.无色溶液中:K+、Fe2+、SO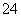 、CO
、CO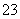
B.存在较多Fe3+的溶液中:Na+、Cl-、SO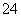 、H+
、H+
C.常温下由水电离出的c(H+)水·c(OH-)水=10-24的溶液中:NH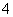 、Cl-、CO
、Cl-、CO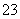 、F-
、F-
D.能使pH试纸变红的溶液中:K+、S2-、CO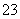 、NO
、NO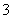
查看答案和解析>>
科目: 来源: 题型:
化学是一门实用性很强的学科,与社会发展的需要有密切的关系。下列说法中,不正确的是( )
A.用食醋可除去热水壶内壁的水垢
B.合成纤维和光导纤维都是新型无机非金属材料
C.酒精能使蛋白质变性,可用于杀菌消毒
D.误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶
查看答案和解析>>
科目: 来源: 题型:
已知: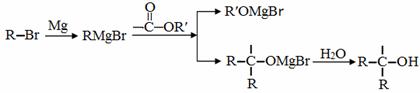
A是一种重要的化工原料,能使溴水反应褪色,且分子内所有的原子都在一条直线上,在不同的条件下,A可以转化为烃B和烃C,B和C的核磁共振氢谱中都只有一个吸收峰,B能使溴水反应褪色而C不能使溴水反应褪色。A~J分别代表一种有机物,并有如下的转化关系:
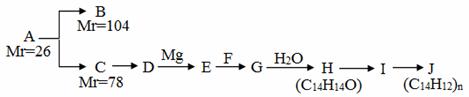
回答下列问题:
(1)A的结构简式为________________;
(2)B的结构简式为_________________;
(3)反应C→D所需要的试剂是_________________________;
(4)H不能发生催化氧化,H的结构简式是____________________________________;
(5) I中的官能团名称是___________________;
(6) I中可能含有的杂质是_____________________(写结构简式);
(7)写出I→J的反应方程式________________________________________________;
(8)H有多种同分异构体,符合下列条件的同分异构体有________种。
①能与FeCl3溶液显紫色;②有二联苯结构;③二联苯上有两个侧链。
其中核磁共振氢谱中吸收峰最少的结构简式是____________________________。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.石墨烯[如图(甲)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(乙)所示]。
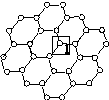
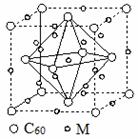
(甲)石墨烯结构 (乙)氧化石墨烯结构 (丙)
(1)图(甲)中,1号C与相邻C形成σ键的个数为________。
(2)图(乙)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(甲)中1号C与相邻C形成的键角。
(3)若将图(乙)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图(丙)所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
Ⅱ.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
 ①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
②H2SeO4比H2SeO3酸性强的原因: 。
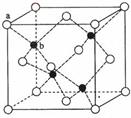
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为540.0pm,其密度为
g/cm3(列式并计算),a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: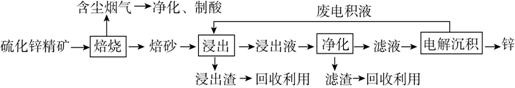
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____________________。
(2)浸出液“净化”过程中加入的主要物质为________,其作用是________。
(3)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(4)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为___________________________________________。
(5)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。” 该炼锌工艺过程主要反应的化学方程式为_________________________________________________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
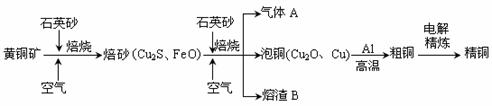
(6) 焙砂含Cu量为20%~50%。转炉中,将焙砂加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。焙砂中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、___________________________;
(7)假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol;
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到 molCu。
查看答案和解析>>
科目: 来源: 题型:
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除。
Ⅰ.活性炭还原法处理氮氧化物。若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
|
| NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(1)该反应的化学方程式为_____________________________________________
(2)T1℃时,该反应的平衡常数K=______________
(3) 30min时改变的的条件是_______________。若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2∶1∶1,则反应的△H__________0(填“<”、“=”、“>”)。
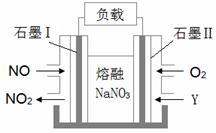 Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
(4)石墨电极Ⅰ的反应式为______________________;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是_______________(填物质的化学式)。
Ⅲ.CH4催化还原法。已知:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
②CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
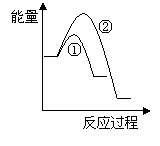
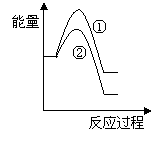
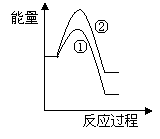
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________________。
(6)假设在某温度下反应①的速率(v1)大于反应②的速率(v2)则下列反应过程能量变化示意图正确的是________(填写正确选项的字母)。
|
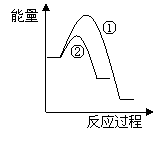


(7)恒温恒容条件下,假设反应①和②同时发生,且v1>v2,请在下图中画出反应体系中c(NO)随时间t变化的总趋势图。
查看答案和解析>>
科目: 来源: 题型:
重铬酸钾 A是橙红色的固体,有强氧化性。①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C;②在C中加入KOH溶液,先生成灰蓝色沉淀D;③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E;④在E中加入H2O2加热则生成黄色溶液F,⑤F用稀硫酸酸化,又变成原来的化合物A的溶液。
已知:氢氧化铬在溶液中存在如下平衡:
Cr3++3OH- Cr(OH)3
Cr(OH)3 H2O+HCrO2
H2O+HCrO2 H2O +H++ CrO2-
H2O +H++ CrO2-
蓝紫色 灰蓝色 绿色
(1)根据上述平衡判断氢氧化铬具有____________(填“碱性”、“酸性”、“两性”)。
(2)写出①的离子方程式______________________________________________;
(3)已知D的溶解度为2.06×10-7g ,则D的溶度积常数为______________。
(4)写出③的离子反应方程式________________________________________
(5)④F溶液中的黄色离子是__________(写化学式);若参加反应的H2O2是5mol,则生成的黄色离子的物质的量为__________________。
(6)金属锡(Sn)是第ⅣA的元素,通过下列方法可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应化学方程式为:__________________________________;
②向①的溶液中再加入过量的FeCl3溶液,发生的反应化学方程式为_________________;
③用已知浓度的A溶液滴定生成的Fe2+。现有金属锡样品wg,经上述各步反应后,用A溶液滴定,A应放在__________(填“酸式”或“碱式”)滴定管中,共用去cmol·L-1的A溶液vmL(锡的相对原子质量用M表示)。求样品中锡的质量分数为_____________(假定杂质不参加反应)。
查看答案和解析>>
科目: 来源: 题型:
S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2,SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。
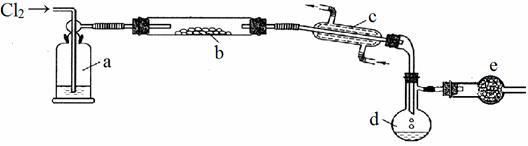
回答下列问题:
(1)写出S2Cl2的电子式_____________________;
(2)写出指定仪器的名称c___________________,d_________________________;
(3)a瓶盛放的试剂是_______________________ ;
(4)b中的反应开始前,需排除装置中的空气,应采取的方法是:_______________________;
(5)装置e中盛放的试剂是_____________其作用是①______________________________ ②___________________________________;
(6)得到纯净的S2Cl2,需要进行的操作是__________;
(7)若将S2Cl2放入水中同时产生沉淀和气体写出反应的方程式
___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某溶液中含有如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、
CO32-、NO3-、SO42-、I-、SiO32-、Cl-且物质的量浓度相同。某同学欲探究该溶液的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加
KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下
层出现紫红色。下列说法正确的是
A.原溶液中肯定不含Mg2+、SiO32-
B.步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32-
C.原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成
D.原溶液中一定含有Mg2+、Cl-
查看答案和解析>>
科目: 来源: 题型:
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-)
C.C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com