
科目: 来源: 题型:
下图是某兴趣小组在实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
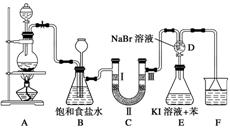
(1)实验室制备氯气的化学方程式为_____________________________________________,
该反应的氧化剂是____________。
(2)装置B中饱和食盐水的作用是______________________________________________;
同时装置B亦是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:________________________________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填“a”、“b”、“c”或“d”)。
| a | b | c | d | |
| Ⅰ | 干燥的有 色布条 | 干燥的有 色布条 | 湿润的有 色布条 | 湿润的有 色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有 色布条 | 湿润的有 色布条 | 干燥的有 色布条 | 干燥的有 色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性强弱。
向装置D中缓缓通入少量氯气时,可以看到________,说明氯的非金属性大于溴。打开活塞,将装置D中的少量溶液加入装置E中,振荡。观察到E中溶液分为两层,上层(苯层)为紫红色,说明溴的非金属性______碘。
(5)下列装置中可以代替装置F的是________。
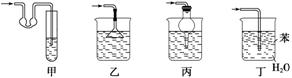
查看答案和解析>>
科目: 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示,写出雾化器中发生反应的化学方程式:________________________________________________。
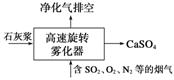
(2)已知NaHSO3溶液显弱酸性,其原因用离子方程式表示为____________。
(3)请按照浓度由大到小的顺序排列0.1 mol·L-1 Na2SO3 溶液中的离子________。Na2SO3溶液放置于空气中一段时间后,溶液的pH________(填“增大”、“减小”或“不变”)。
(4)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
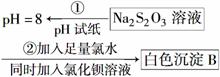
实验①可说明________(填字母)。
A.该Na2S2O3溶液中水电离的c(OH-)=10-8 mol·L-1
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3能发生水解,其离子方程式为S2O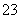 +2H2O===H2S2O3+2OH-
+2H2O===H2S2O3+2OH-
实验②说明Na2S2O3具有________性。写出发生反应的离子方程式______________。
查看答案和解析>>
科目: 来源: 题型:
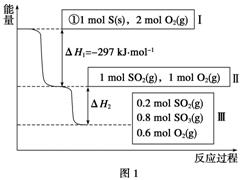
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1]:
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:__________________。
(2)ΔH2=____________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为________,若溶液中发生了氧化还原反应,则该过程的离子方程式为____________。
(5)恒容条件下,下列措施中能使2SO2(g)+O2(g)2SO3(g)中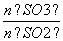 增大的有________。
增大的有________。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
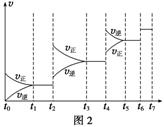
(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为________________。
查看答案和解析>>
科目: 来源: 题型:
某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内最多,是一种常用的食品添加剂。该化合物具有如下性质:
(ⅰ)在25 ℃时,电离平衡常数K1=3.9×10-4,K2=5.5×10-6
(ⅱ)A+RCOOH(或ROH)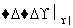 有香味的产物
有香味的产物
(ⅲ)1 mol A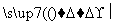 慢慢产生1.5 mol气体
慢慢产生1.5 mol气体
(ⅳ)核磁共振氢谱表明A分子中有5种不同化学环境的氢原子。
与A相关的反应框图如下:
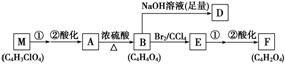
(1)根据化合物A的性质,对A的结构可作出的判断是
________________________________________________________________________(填序号)。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有羟基 d.有—COOR官能团
(2)写出A、F的结构简式:
A:________________________________________________________________________;
F:________________________________________________________________________。
(3)写出下列反应类型:A—→B____________;B—→E____________。
(4)写出下列反应的反应条件:
E—→F第①步反应___________________________________________________________。
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢。写出该反应的化学方程式:____________________________________________________。
(6)写出与A具有相同官能团的A的同分异构体的结构简式:_________________________
_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列有关电解质溶液的叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液一定为中性
B.在Na2S溶液中:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO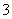 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
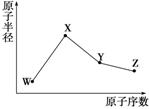 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是( )
A.对应气态氢化物的稳定性:Y>Z
B.化合物XZW既含离子键也含共价键
C.对应简单离子半径:W>X
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目: 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO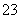 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO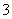 )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目: 来源: 题型:
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路(未闭合K)后发现
为电镀槽。接通电路(未闭合K)后发现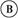 上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料的铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
下列描述正确的是( )
A.在pH=1的溶液中,NH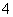 、K+、ClO-、Cl-可以大量共存
、K+、ClO-、Cl-可以大量共存
B.MgO可以除去MgCl2溶液中的FeCl3
C.足量铁粉与稀硝酸反应:Fe+4H++NO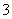 ===Fe3++2H2O+NO↑
===Fe3++2H2O+NO↑
D.向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO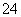
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com