
科目: 来源: 题型:
下列水解方程式正确的是( )
A.CO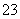 +H2O
+H2O  2OH-+H2CO3 B.NH
2OH-+H2CO3 B.NH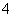 +H2O
+H2O  NH3·H2O+H+
NH3·H2O+H+
C.HCO3 ̄+H2O  CO
CO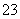 +H3O+ D.F-+H2O =HF+OH-
+H3O+ D.F-+H2O =HF+OH-
查看答案和解析>>
科目: 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g)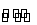 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
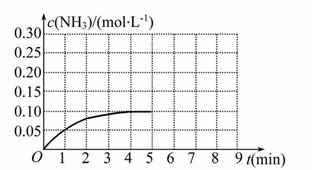
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
合成氨的温度和压强通常控制在约500℃以及20 MPa~50 MPa的范围,当进入合成塔的N2和H2的体积比为1∶3时,经科学实验测定,在相应条件下N2和H2反应所得氨的平衡浓度(体积分数)如下表所示:

而实际上从合成塔出来的混合气体中含有氨约为15%。
请回答下列问题:
(1)298 K下合成氨时,每生成1 mol 氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在的条件下进行反应,测得反应放出的热量总小于92.4 kJ,其原因是______________。
(2)实际上从合成塔出来的混合气体中氨的体积分数小于理论值的根本原因是_______________。
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应未达到平衡状态
(3)若工业生产中N2和H2按投料比1∶2.8的比例进入合成塔,那么转化率较大的应该是_________,采用此投料比的原因是______________,
若从合成塔出来的混合气体中氨的体积分数仍为15%,则N2和H2的转化率之比是__________。
查看答案和解析>>
科目: 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器内,发生如下反应N2+3H2 2NH3。
2NH3。
(1)若反应到某时刻t时,n(N2)=13 mol, n(NH3)=6 mol,a=_______。
(2)反应到达平衡时,混合气体体积为716.8 L(标准状况)其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量_________。
(3)混合气体中a∶b=_________。
(4)平衡混合气体中n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目: 来源: 题型:
一定温度下,向密闭容器中充入1.0 mol N2和3.0 mol H2,反应达到平衡时,测得NH3的物质的量为0.6 mol。若该容器中开始时N2的物质的量为2.0 mol,H2为6.0 mol,则平衡时NH3的物质的量为( )
A.若为定容容器,n(NH3)=1.2 mol
B.若为定容容器,n(NH3)<1.2 mol
C.若为定压容器,n(N H3)=1.2 mol
H3)=1.2 mol
D.若为定压容器,n(NH3)>1.2 mol
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
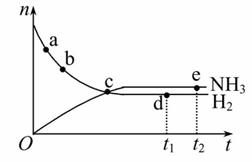
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,向一个2 L的真空密闭容器中事先装入催化剂,通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1 mol·L-1·min-1,则所经过的时间是( )
A.5 min B.4 min C.3 min D.2 min
查看答案和解析>>
科目: 来源: 题型:
可逆反应N2(g)+3H2(g)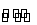 2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
查看答案和解析>>
科目: 来源: 题型:
对于可逆反应N2(g)+3H2(g)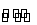 2NH3(g)(正反应为放热反应),下列说法中正确的是( )
2NH3(g)(正反应为放热反应),下列说法中正确的是( )
A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡的小
B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高了NH3的产率
C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率
D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com