
科目: 来源: 题型:
除去下列物质中所含少量杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 盐析、过滤、洗涤 |
查看答案和解析>>
科目: 来源: 题型:
对下列各组物质:①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KCl;④BaSO4和AgCl,可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离的是( )
A.只有① B.③④ C.②③ D.②④
查看答案和解析>>
科目: 来源: 题型:
某实验小组只领取下列仪器(或用品):铁架台(带铁夹、铁圈)、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸。只应用上述仪器用品,不能进行的实验操作是( )
A.蒸发 B.萃取 C.过滤 D.蒸馏
查看答案和解析>>
科目: 来源: 题型:
呋喃酚是合成农药的重要中间体,其合成路线如下:
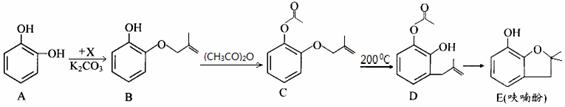
(1)A物质核磁共振氢谱共有 个峰,B→C的反应类型是 。
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式: 。
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是 。
(4)下列有关化合物C、D的说法正确的是 。
①可用氯化铁溶液鉴别C和D ②C和D含有的官能团完全相同
③C和D互为同分异构体 ④C和D均能使溴水褪色
(5)E的同分异构体很多,写出一种符合下列条件的芳香族同分异构体的结构简式:
。
①环上的一氯代物只有一种 ②含有酯基 ③能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体:按下图装置进行制取。
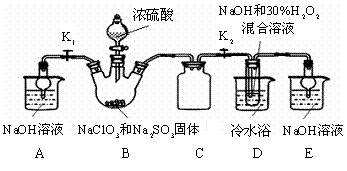 |
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶; ii.趁热过滤; iii. ; iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
NaClO2中含少量Na2SO4可用重结晶的方法提纯。下列有关物质的提纯方案不正确的
是
| 被提纯的物质 [括号内物质是杂质] | 除杂试剂 | 除杂方法 | |
| a | CO(g) [CO2(g)] | NaOH溶液、 浓H2SO4 | 洗气 |
| b | NH4Cl(aq) [Fe3+(aq)] | NaOH溶液 | 过滤 |
| c | Cl2(g) [HCl(g)] | 饱和食盐水、浓H2SO4 | 洗气 |
| d | Na2CO3(s) [NaHCO3(s)] | — | 加热 |
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.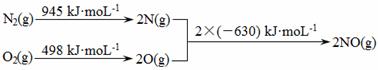
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2= -565 kJ·mol-1
2CO2 (g) ΔH2= -565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
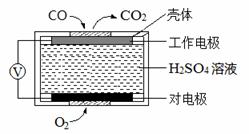 (2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因
。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②l0 min内,反应的平均反应速率v (CO2)= 。
③T℃时,该反应的平衡常数K= 。
查看答案和解析>>
科目: 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如右(中间用离子交换膜隔开):
 4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
。
查看答案和解析>>
科目: 来源: 题型:
已知:NH2COO-+2H2O  HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
所示。以下分析正确的是
A.无法判断T1和T2的大小关系
B.T1 ℃时,第6min反应物转化率为6.25%
C.T2 ℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1
D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
查看答案和解析>>
科目: 来源: 题型:
室温时,pH = 11的稀氨水,下列判断正确的是
A.若升高温度,Kb、Kw均增大
B.用稀盐酸恰好中和时,溶液的pH=7
C.加水稀释,c(NH4+)·c(OH-)增大
D.加入pH = 11的NaOH溶液,NH3·H2O电离平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂。下列关于物质X的说法正确的是
A X分子式为C6H6O7
B 1 mol物质X可以和3 mol氢气发生加成
C X分子不可以发生消除反应
D 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com