
科目: 来源: 题型:
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是
K=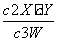
查看答案和解析>>
科目: 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目: 来源: 题型:
高温及催化剂作用下,某反应的平衡常数K=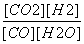 。恒容时,温度升高,H2浓度减小,下列说法正确的是( )
。恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的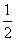
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,正反应速率减小,逆反应速率增大
D.该反应化学方程式为CO2+H2 CO+H2O ΔH<0
查看答案和解析>>
科目: 来源: 题型:
某温度下反应H2(g)+I2(g)  2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是( )
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是( )
A.反应正好达平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
已知某温度下,反应SO2(g)+NO2(g)  SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
A.该温度下反应2SO2(g)+2NO2(g)  2SO3(g)+2NO(g)的平衡常数为0.48
2SO3(g)+2NO(g)的平衡常数为0.48
B.若该反应ΔH<0,则升高温度化学平衡常数K减小
C.若升高温度,逆反应速率减小
D. 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.自发反应的熵一定增大,非自发反应的熵一定减小
B.凡是放热反应都是自发的,因为吸热反应都是非自发的
C.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验,回答相关问题。
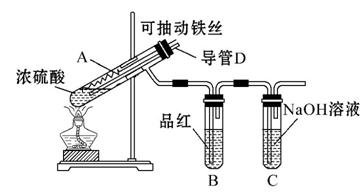
(1)用“可抽动铁丝”代替“直接投入铁片”的优点是____________
(2)能说明有SO2气体产生的实验现象是___________ _
(3)反应后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______ ______
(4)反应一段时间后,他们对A中溶液的金属离子进行探究,请完成相关问题。
①提出假设:
假设1:只含有Fe3+;
假设2: ___ _________;
假设3:既有Fe2+,又有Fe3+。
②设计实验方案验证假设3。写出实验步骤、预期现象和结论。
限选试剂及仪器:稀硫酸、KMnO4溶液、NaOH溶液、淀粉-KI溶液、H2O2溶液
| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管Ⅰ、Ⅱ备用 | |
| 步骤二:往试管Ⅰ中, ____________ | |
| 步骤三: |
查看答案和解析>>
科目: 来源: 题型:
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的是证明CO具有还原性的实验装置。
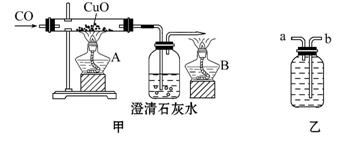
(1)实验时应先点燃 (填“A”或“B”)处的酒精灯。
(2)硬质试管中反应的化学方程式为 。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图是他设计的贮气瓶,尾气应从 (选“a”或“b”)口通入(其他装置略)。
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要 ,理由是 。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的? 。
查看答案和解析>>
科目: 来源: 题型:
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂,某研究性学习小组通过下列实验由废铁屑制备FeSO4·7H2O晶体。
制备步骤如下:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用蒸馏水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50℃~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)以上实验中存在着明显不合理的步骤及其理由是___________ _。
(2)实验步骤④中用少量冰水洗涤晶体,其目的是__________ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com