
科目: 来源: 题型:
“辛烷值”用来表示汽油的质量,汽油中异辛烷爆震程度最小,将异辛烷爆震值标定为100,以下是异辛烷的球棍模型:
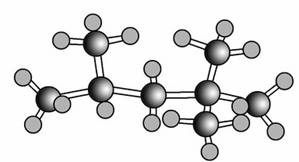
则利用系统命名法,异辛烷的系统名称为( )
A.1,1,3,3-四甲基丁烷
B.2,2,4-三甲基己烷
C.2,4,4-三甲基戊烷
D.2,2,4-三甲基戊烷
查看答案和解析>>
科目: 来源: 题型:
观察下列模型,其中只有C、H、O三种原子,下列说法正确的是( )
| 序号 | 1 | 2 | 3 | 4 |
| 模型示 意图 |
|
|
|
|
A.模型1对应的物质含有双键
B.模型2对应的物质具有漂白性
C.模型1对应的物质可与模型3对应的物质发生酯化反应
D.模型3、模型4对应的物质均具有酸性,且酸性4强于3
查看答案和解析>>
科目: 来源: 题型:
如图甲、乙是电化学实验装置。
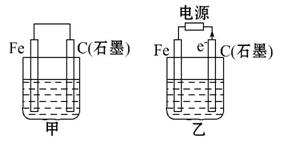
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为 ;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
查看答案和解析>>
科目: 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
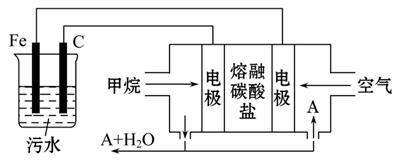
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
Ⅰ.________________________________________________________________;
Ⅱ.________________________________________________________________。
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是________
__________________________________________________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是___
___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下图为相互串联的甲、乙两个电解池。
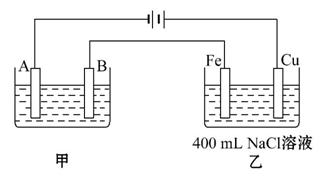
试回答:
(1)若甲池利用电解原理在铁上镀银,则A是 、 (依次填电极材料和电极名称),电极反应是 ;
B是 、 (依次填电极材料和电极名称),电极反应是 ;
应选用的电解质溶液是 。
(2)若甲池阴极增重43.2 g且乙池中阴极上一直都有气体产生,则乙池中阴极上放出的气体在标准状况下的体积是 L。
查看答案和解析>>
科目: 来源: 题型:
将质量相等的银片和铂片插入硝酸银溶液(足量)中,银片与电源正极相连,铂片与电源负极相连。以电流强度1 A通电10 min,然后反接电源,以电流强度2 A继续通电10 min。下列为表示银电极的质量、铂电极的质量、电解池中产生气体的质量和电解时间的关系图,正确的是( )
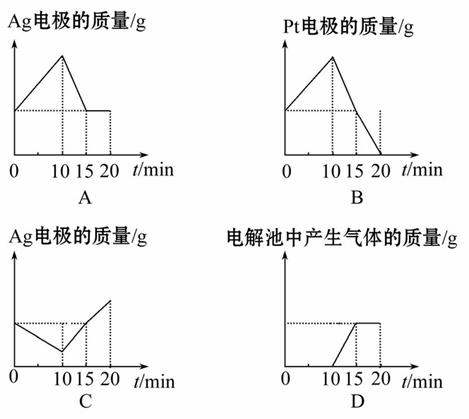
查看答案和解析>>
科目: 来源: 题型:
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-====2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
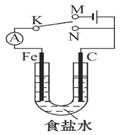 D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。
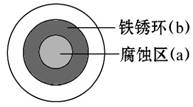
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-====4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-====Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com