
科目: 来源: 题型:
Ⅰ. 乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:
________________________________________________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g) === CH3OCH3(g) + H2O(g) △H1 == -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OH(g) === C2H4(g) + 2H2O(g) △H2 == -29.1 kJ·mol—1
乙醇异构化反应 C2H5OH(g) === CH3OCH3(g) △H3 == + 50.7 kJ·mol—1
则乙烯气相直接水合反应C2H4(g) + H2O(g)=== C2H5OH(g)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+ ==== CO2↑+ 2Cr3+ + 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+ ――― ____Cr3+ +____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7
恰好与9.6 mL 1.0 mol/L FeSO4溶液完全反应。
(3)请配平第②步中离子方程式(配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
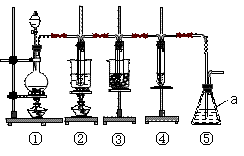
上图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液。
请回答下列问题:
(1)仪器a的名称是_________________。
(2)实验室制取氯气的离子方程式为___________________________________________。
为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____(填字母代号)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
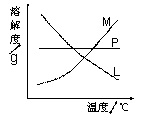 (3)比较制取氯酸钾和次氯酸钠的条件,二者的差异
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异
是______________________________________。反应完毕
经冷却后,②的试管中有大量晶体析出。在右图中符合该晶
体溶解度曲线的是_____(填字母代号);从②的试管中分离出
晶体的操作是________,该操作需要用到的玻璃仪器有____________________________。
(4)次氯酸钠中存在的化学键类型为_______________________________。
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_________色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _________________________________________ |
| 然后溶液从无色逐渐变为_________色 | _________________________________________ |
(6)装置⑤的作用是___________________________。
查看答案和解析>>
科目: 来源: 题型:
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略)。
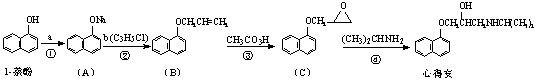
回答下列问题:
(1)试剂b的结构简式为_______________,b中官能团的名称是__________________。
(2)③的反应类型是________________。
(3)心得安的分子式为_________________。
(4)试剂b可由丙烷经三步反应合成:
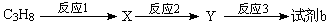 反应1的试剂与条件为________________。反应3的反应类型是_________________。
反应1的试剂与条件为________________。反应3的反应类型是_________________。
X的核磁共振氢谱显示其分子中含有2种氢原子,反应2的化学方程式为:
_________________________________________________。若一次取样,检验X中所含官能团,按使用的先后顺序写出所用试剂:_____________________________________。
(5)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。
D的结构简式为__________________________;由F生成一硝化产物的化学方程式为:
__________________________________________________________________________,芳香化合物F的名称是________________________________。
查看答案和解析>>
科目: 来源: 题型:
物质A ~ G有下图所示转化关系(部分反应物、生成物
未列出)。其中A为某金属矿的主要成分,经过一系列反应可
得到气体B和固体C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
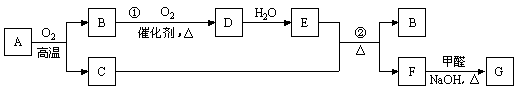
请回答下列问题:
(1)写出下列物质的化学式:B___________、G___________。
(2)反应②的化学方程式是__________________________________________________。
(3)利用电解可提纯C物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_______________,阳极物质是______________。MnO2是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为_____________________________________________。
(4)将0.20 mol B和0.10 mol O2充入一个固定容积为5 L的密闭容器中,在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含D 0.18 mol,则v(O2)== ______________mol/(L·min);若温度不变,继续通入0.20 mol B和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol < n(D) < ________mol。
 (5)写出F G转化过程中,甲醛参与反应的化学方程式:
(5)写出F G转化过程中,甲醛参与反应的化学方程式:
___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列操作不能达到实验目的的是
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4—完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目: 来源: 题型:
下列有关电解质溶液的说法正确的是
A.pH = a的氨水溶液,稀释10倍后,其pH = b,则a = b + 1
B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
C.在Na2C2O4稀溶液中,c(OH-) = c(H+) + c(HC2O4—) + 2c(H2C2O4)
D.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:
3c(Na+) = 2[c(CO32—) + c(HCO3—) + c(H2CO3) ]
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA
B.常温常压下,1 mol甘氨酸中含C—H键数目为3 NA
C.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA
D.50℃时,10 L pH = 13的NaOH溶液中含有的OH—数目为NA
查看答案和解析>>
科目: 来源: 题型:
以下有关原子结构及元素周期律的叙述中正确的是
A.同种元素的原子均有相同的质子数和中子数
B.同主族元素的简单阴离子还原性越强,水解程度越大
C.同周期金属元素的化合价越高,其原子失电子能力越强
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液
B.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
C.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
 D.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取
D.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取
查看答案和解析>>
科目: 来源: 题型:
化学已渗透到人类生活的各个方面。下列说法正确的是
A.氧化亚铁能与酸反应,可用于制作红色涂料
B.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
D.维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com