
科目: 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
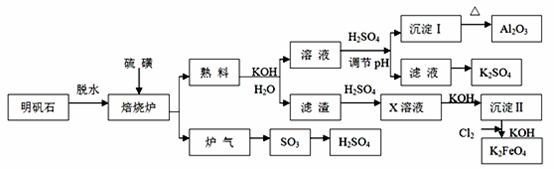
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A.将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2mL
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
科目: 来源: 题型:
下列解释事实的化学方程式或离子方程式正确的是
A.以MnO2为原料制得的MnCl2溶液中常含有Cu2+等金属离子,通常添加难溶电解质MnS使这些离子形成硫化物沉淀而除去:Cu2+ + S2-=CuS↓
B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C.金属钠在空气中放置表面会很快失去金属光泽:2Na + O2 = Na2O2
D.向硫酸亚铁铵[(NH4)2Fe(SO4) 2·6H2O]的稀溶液中加入足量Ba(OH)2稀溶液:NH4+ + Fe2+ + SO42-+ Ba2+ +3OH- = BaSO4↓+ Fe(OH)2↓+ NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
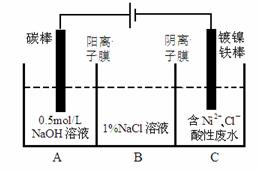
已知: ①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— — 4e— == O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目: 来源: 题型:
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。向0.1mol/LNaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是
A.2c(CO32-)+c(HCO3-)=0.1mol/L
B.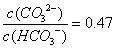
C.该溶液中加BaCl2溶液,溶液pH增大
D.在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小
查看答案和解析>>
科目: 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表,下列说法正确的是
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | Y+与NH4+的质子数、电子数均相等 |
| Z | 第三周期原子半径最小的金属 |
A.Z的氧化物属于碱性氧化物 B.离子半径:Z>W
C.最高价氧化物对应水化物的碱性:Y>Z D.气态氢化物的热稳定性:X>W
查看答案和解析>>
科目: 来源: 题型:
常温下,用 0.1000 mol·L
 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L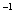
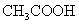 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
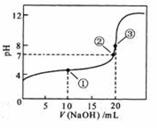
A.点①所示溶液中: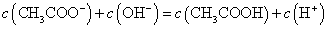
B.点②所示溶液中: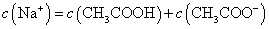
C.点③所示溶液中: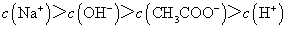
D.滴定过程中可能出现: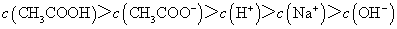
查看答案和解析>>
科目: 来源: 题型:
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+ 离子中含有36个电子 B.H2与H3属于同素异形体
C.C60的摩尔质量为720 D.O2与O4属于同位素
查看答案和解析>>
科目: 来源: 题型:
有机物A、B、C、D、E、F的转化关系如下:
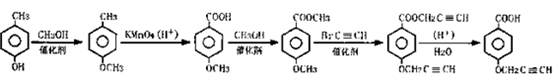
A B C D E F
(1)化合物D中含氧官能团有 、 (填名称)。
、 (填名称)。
(2)鉴别化合物E和F最适宜的试剂是 。化合物D到E的反应类型是 。
(3)化合物A最多有 个原子共平面。
(4)D的同分异构体很多,符合下列条件的同分异构体有____种。
①苯的衍生物且能使FeCl3溶液显紫色;②含有一个羧基;③分子中无甲基
查看答案和解析>>
科目: 来源: 题型:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
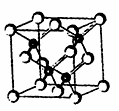
(1)镓的基态原子的电子排布式是 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
(5)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com