
科目: 来源: 题型:
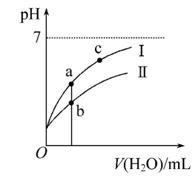
已知:25℃时某些弱酸的电离平衡常数如表所示。下面图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法中正确的是( )
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O====
2HClO+CO32-
C.图像中a、c两点处的溶液中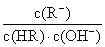 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目: 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述中不正确的是
H++CH3COO-,下列叙述中不正确的是
( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后pH=5
B.在相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的
100倍
C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定等于正盐的pH
D.碳酸钠溶液在室温时的pH一定大于60℃时的pH
查看答案和解析>>
科目: 来源: 题型:
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-====HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
查看答案和解析>>
科目: 来源: 题型:
关于pH相同的醋酸和盐酸溶液,下列叙述中不正确的是
( )
A.取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸
C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多
D.两种酸溶液中c(CH3COO-)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
下列事实不能证明HNO2是弱电解质的是( )
①滴入酚酞,NaNO2溶液显红色
②用HNO2溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
④0.1 mol·L-1HNO2溶液的pH=2
⑤HNO2与CaCO3反应放出CO2气体
⑥c(H+)=0.1 mol·L-1的HNO2溶液稀释至1 000倍,pH<4
A.①⑤ B.②⑤
C.③⑥ D.③④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.强电解质一定是离子化合物,弱电解质一定是共价化合物
B.强电解质一定是易溶化合物,弱电解质一定是难溶化合物
C.SO3溶于水后水溶液导电性很强,所以SO3是强电解质
D.属于共价化合物的电解质在熔化状态下一般不导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com