
科目: 来源: 题型:
在基态钾原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.2p能级上6个电子能量完全相同
C.p能级上电子能量一定高于s能级上电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.由同种元素组成的物质肯定属于纯净物
B.一种元素可形成多种离子,但只能是带同种电荷的离子
C.含金属元素的离子不一定都是阳离子
D.具有相同质子数的粒子都属于同种元素
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.某粒子核外电子排布为2、8、8结构,则该粒子一定是氩原子
B.Na+的半径大于F-的半径
C.F-、Na+、Mg2+、Al3+是与He具有相同电子层结构的离子
D.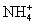 与H3O+具有相同的质子数和电子数
与H3O+具有相同的质子数和电子数
查看答案和解析>>
科目: 来源: 题型:
铀(U)是重要的核工业原料,其中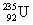 是核反应堆的燃料,下列关于
是核反应堆的燃料,下列关于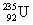 和
和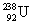 的说法正确的是( )
的说法正确的是( )
A.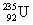 和
和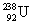 都含有92个中子
都含有92个中子
B.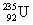 和
和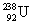 互为同位素
互为同位素
C.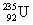 和
和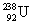 的核外电子数不同
的核外电子数不同
D.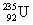 和
和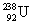 分别含有143和146个质子
分别含有143和146个质子
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 (保留小数点后四位)。
[实验二]探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案: 。
查看答案和解析>>
科目: 来源: 题型:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平 衡常数 | Ka= 1.8×10-5 | Ka1= 4.3×10-7 | Ka2= 5.6×10-11 | Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大的排列顺序是 (用编号填写)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。
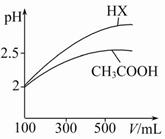
查看答案和解析>>
科目: 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向 (填“正”或“逆”)反应方向移动,理由是 。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向 (填“正”或“逆”)反应方向移动,溶液中c(A-)将 (填“增大”“减小”或“不变”),溶液中c(OH-)将 (填“增大”“减小”或“不变”)。
(3)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com