
科目: 来源: 题型:
现有常温下的六份溶液:
①0.01 mol·L-1CH3COOH溶液;
②0.01 mol·L-1HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 ;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(填“>”“<”或“=”);
(3)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”“<”或“=”);
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈 (填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目: 来源: 题型:
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
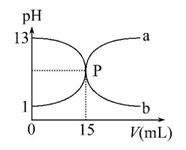
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目: 来源: 题型:
常温时,将V1mLc1mol·L-1的氨水滴加到V2mLc2mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N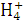 )=c(Cl-)
)=c(Cl-)
C.若混合溶液的pH=7,则混合液中c(N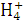 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合溶液的pH<7,则一定有c1<c2
查看答案和解析>>
科目: 来源: 题型:
下图是将手持技术用于未知浓度盐酸滴定20.00 mL 0.1 mol·L-1NaOH溶液,测定盐酸浓度的实验(盐酸的滴定速率为0.098 mL·s-1)。下列有关说法中不正确的是( )
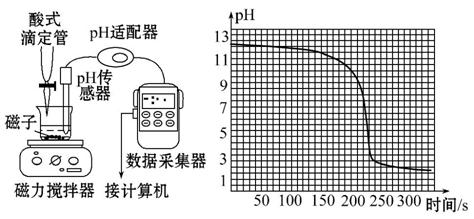
A.此中和滴定的反应原理是:H++OH-====H2O
B.H+与OH-反应生成水使溶液的pH发生变化,用传感器能精确测定出来
C.与传统中和滴定比较,可以避免酸碱指示剂对终点准确判断的难题
D.根据图中计算机绘制的酸碱中和滴定曲线可知:250 s时达到滴定终点
查看答案和解析>>
科目: 来源: 题型:
某研究小组为测定食用白醋中醋酸的含量进行的如下操作,正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1.00 mol·L-1NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
查看答案和解析>>
科目: 来源: 题型:
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
| 实验编号 | c(HA) / mol·L-1 | c(NaOH) / mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是( )
A.c1一定大于0.2
B.HA的电离方程式是HA H++A-
H++A-
C.乙反应后溶液中:c(Na+)=c(HA)+c(A-)
D.甲反应后溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O====HA+NaHCO3;2NaB+CO2+H2O====
2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是
( )
A.HA较强 B.HB较强 C.两者一样 D.无法比较
查看答案和解析>>
科目: 来源: 题型:
已知NaHSO4在水中的电离方程式为:NaHSO4====Na++H++S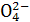 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
B.水电离出来的c(H+)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c(S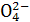 )
)
D.该温度高于25℃
查看答案和解析>>
科目: 来源: 题型:
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为
( )
A.9 B.10 C.11 D.12
查看答案和解析>>
科目: 来源: 题型:
室温下,已知某溶液中由水电离生成的H+和OH-的物质的量浓度乘积为1×10-24,则在该溶液中,一定不能大量存在的离子是( )
A.S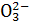 B.N
B.N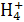 C.N
C.N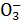 D.HC
D.HC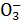
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com