
科目: 来源: 题型:
下列关于化学反应限度的说法中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目: 来源: 题型:
反应C(s)+H2O(g)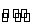 CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+ H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器体积缩小一倍
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使体系体积增大
查看答案和解析>>
科目: 来源: 题型:
锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是2Zn+O2====2ZnO。下列有关它的说法正确的是( )
A.锌为电池负极,发生氧化反应
B.电解质溶液是酸性溶液
C.电池工作时,氧气与锌直接化合,生成氧化锌
D.负极发生的反应是:Zn-2e-+H2O====ZnO+2H+
查看答案和解析>>
科目: 来源: 题型:
反应2SO2(g)+O2(g)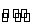 2SO3(g)经过一段时间后,SO3的浓度增加了
2SO3(g)经过一段时间后,SO3的浓度增加了
0.4 mol·L-1,测得在这段时间内用SO2的浓度变化表示的反应速率为
0.04 mol·L-1·s-1,则“这段时间”为( )
A.10 s B.5 s C.2.5 s D.0.1 s
查看答案和解析>>
科目: 来源: 题型:
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和
5.4 mol·L-1,在一定条件下它们反应生成NH3,10 min后测得N2的浓度是
0.8 mol·L-1,则在这10 min内NH3的平均反应速率是( )
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
下列关于能量转化的认识中错误的是( )
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.电池充电是将电能转化为化学能
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目: 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①引发铝热反应的实验操作是 ,
产物中单质B是 。
(2)②中所发生的各反应的化学方程式为
、
。
(3)③中所发生的各反应的离子方程式为
、
。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
查看答案和解析>>
科目: 来源: 题型:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
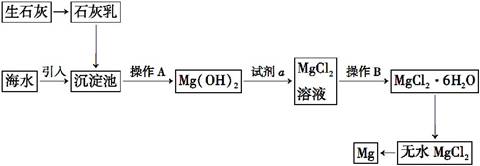
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,
写出在沉淀池中反应的离子方程式
。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
。
从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)该同学的想法,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com