
科目: 来源: 题型:
科学家一直致力于“人工固氮”的新方法研究.
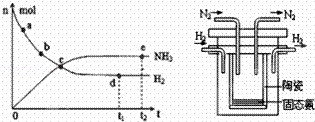
(1)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ•mol﹣1.
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示.下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图,阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)⇌2NH3(g)+ O2(g)△H=a kJ•mol﹣1
O2(g)△H=a kJ•mol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;△S 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJ•mol﹣1则N2(g)+3H2O(1)=2NH3(g)+ O2(g)△H= kJ•mol﹣1.
O2(g)△H= kJ•mol﹣1.
查看答案和解析>>
科目: 来源: 题型:
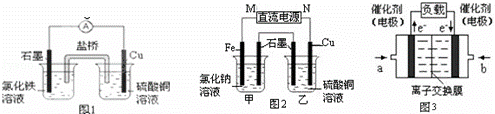
(1)图1装置发生反应的离子方程式为 .
(2)图2装置中甲烧杯盛放100mL 0.2mol•L﹣1的NaCl溶液,乙烧杯盛放100mL 0.5mol•L﹣1L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为 极,甲烧杯中铁电极的电极反应为 .
②乙烧杯中电解反应的化学方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ﹣ ,
甲醇燃料电池的总反应化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
科目: 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
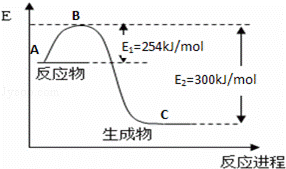
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H﹣H | N≡N |
| 键能/kJ•mol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能 kJ•mol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 ,E2 (填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中进行下列反应:2SO2(g)+O2(g)⇌2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L﹣1、0.1mol•L﹣1、0.2mol•L﹣1,当反应达到平衡时,可能存在的数据是( )
|
| A. | SO2为0.4mol•L﹣1,O2为0.2 mol•L﹣1 |
|
| B. | SO2为0.15 mol•L﹣1 |
|
| C. | SO2,SO3均为0.25 mol•L﹣1 |
|
| D. | SO3为0.4 mol•L﹣1 |
查看答案和解析>>
科目: 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)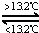 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是( )
|
| A. | △H1>△H2 |
|
| B. | 锡在常温下以灰锡状态存在 |
|
| C. | 灰锡转为白锡的反应是放热反应 |
|
| D. | 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏 |
查看答案和解析>>
科目: 来源: 题型:
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
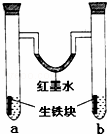
|
| A. | 红墨水柱两边的液面变化是左高右低 |
|
| B. | b试管中溶液pH值减小 |
|
| C. | 两试管中相同的电极反应式是:Fe﹣3e﹣=Fe3+ |
|
| D. | a试管中阳极反应式为:O2+2H2O﹣4e﹣=4OH﹣ |
查看答案和解析>>
科目: 来源: 题型:
下列说法或表示方法正确的是( )
|
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 |
|
| B. | 由C(石墨)→C(金刚石)△H=+119kJ•mol﹣1可知,金刚石比石墨稳定 |
|
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 |
|
| D. | 在稀溶液中,H+(aq)+OH﹣(aq)═(H2O)(l)△H=﹣57.3kJ•mol﹣1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目: 来源: 题型:
如图是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过.下列说法正确的是( )
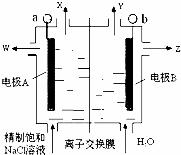
|
| A. | 加入的H2O可用稀NaCl溶液代替,以增加导电能力 |
|
| B. | W是稀的氯化钠溶液 |
|
| C. | OH﹣从阴极区向阳极区移动 |
|
| D. | b电极反应式:2Cl﹣﹣2e﹣=Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:
已知热化学方程式H2(g)+F2(g)═2HF(g)△H=﹣270kJ•mol﹣1,下列说法中错误的是( )
|
| A. | 在上述条件下,44.8L氟化氢气体分解成22.4L氢气与22.4L氟气吸收270kJ热量 |
|
| B. | 在上述条件下,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270kJ |
|
| C. | 在上述条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
|
| D. | 上述热化学方程式还可表示为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com