
科目: 来源: 题型:
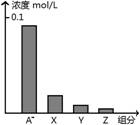
常温下,0.2 mol/L的一元酸.HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y) =c(Na+)
查看答案和解析>>
科目: 来源: 题型:
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
① CH2Cl—CHCl—CH=CH2 (1,2—加成)
② CH2Cl—CH=CH—CH2Cl (1,4—加成)
③ CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构( )
A.6种 B.10种 C.12种 D.14种
查看答案和解析>>
科目: 来源: 题型:
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
查看答案和解析>>
科目: 来源: 题型:
| Y | Z | R |
| W |
下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是( )
A.五种元素的原子最外层电子数一定都大于2
B.X、Z原子序数可能相差18
C.Z可能是氯元素
D.Z的氧化物与X单质不可能发生置换反应
查看答案和解析>>
科目: 来源: 题型:
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A.7.8g过氧化钠含有的共用电子对数为0.2NA
B.2H2O2(l)=2H2O(l)+O2(g) ΔH=−98.2 kJ·mol−1,ΔS=70.5 J·mol−1·K−1,该反应低温能自发进行
C.过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D.在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
查看答案和解析>>
科目: 来源: 题型:
化学与环境、生活、材料密切相关。下列说法正确的是( )
A.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B.二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是相同的
C.通过有机合成,可以制造出比钢铁更强韧的新型材料
D.气溶胶和液溶胶的差别在于分散质的物质状态
查看答案和解析>>
科目: 来源: 题型:
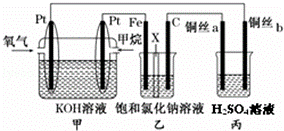
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜. 请按要求回答相关问题:
(1)甲烷燃料电池正极反应式为 .
(2)石墨电极(C)的电极反应式为 .
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L.
(4)丙中两根铜丝电极的质量均为64g,电解质为500mL 0.1mol•L﹣1H2SO4溶液.电解一段时间后,a端收集到1.12L气体(标准状况下),取出电极,对电极进行干燥并称重,测得b电极的质量减少6.4g.求此时所得溶液的物质的量浓度.
查看答案和解析>>
科目: 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
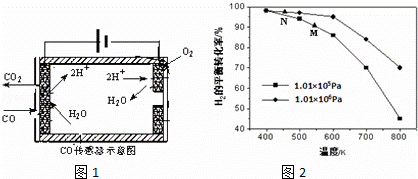
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+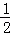 O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
查看答案和解析>>
科目: 来源: 题型:
按要求回答下列问题:
(1)①反应Cl2+H2O⇌H++Clˉ+HClO其化学平衡常数K的表达式为:
②在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH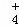 )=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
)=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
(2)常温下,向一定体积的0.1mol•L﹣1醋酸溶液中加水稀释后,下列说法正确的是 .
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中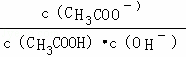 不变
不变
D.溶液中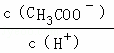 减小
减小
(3)①常温下将0.15mol•L﹣1的稀硫酸V1 mL与0.1mol•L﹣1的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积的变化忽略不计,硫酸电离方程式:H2SO4=2H++SO42﹣).
②常温下将pH=3的醋酸溶液V1 mL与pH=11的NaOH溶液V2 mL混合,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7 mol•L﹣1
B.若V1=V2,混合后溶液的pH一定等于 7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
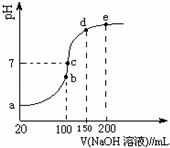
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a~e 5个点,回答下列问题:
①水的电离程度最大的是 点;
②在c点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目: 来源: 题型:
氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液,或反之).现用0.1mol•L﹣1酸性KMnO4溶液(标准液)滴定未知浓度的H2O2水溶液(待测液),反应离子方程式是:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O,请回答下列问题:
(1)该滴定实验一定不需要用到的仪器有下列中的 (填字母).
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、白纸 D、锥形瓶E、铁架台 F、滴定管夹 G、量筒(10mL)
(2)滴定时是否需要添加指示剂 ,理由 .
(3)实验中取H2O2溶液V mL,滴定前后滴定管液面刻度分别为a mL和b mL,则H2O2浓度为 .
(4)在滴定过程中,下列操作会使过氧化氢溶液测定浓度比实际浓度偏高的是 .
①盛装标准液的滴定管用蒸馏水洗净后未用标准液润洗
②锥形瓶中有少量蒸馏水,实验时没有烘干处理
③读数时,滴定前平视,滴定后俯视.
④滴定前盛装标准液的滴定管尖端气泡未排除,滴定后气泡消失
A.②③B.①④C.①③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com