
科目: 来源: 题型:
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂: 1.00 mol·L-1 HNO3、2.00 mol·L-1
HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
__________________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和________。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有__________。
②干燥管中应放置的试剂是______。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL
0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是_____________________________________
___________________________________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:____________
_____________________________________;
(4)该反应达到平衡时反应物X的转化率α等于______________。
查看答案和解析>>
科目: 来源: 题型:
某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+
NH4HCO3+
NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法中正确的是 ( )
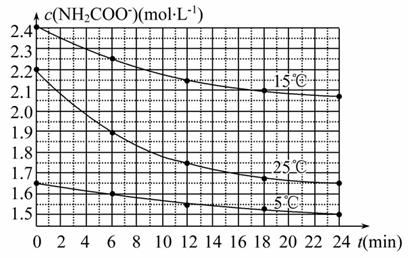
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25 ℃时,0~6 min,v(NH2COO-)为0.05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目: 来源: 题型:
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( )
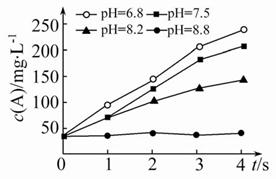
A.若增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小,反应速率越快
D.可采用调节pH的方法使反应停止
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,当单独改变可逆反应N2+3H2 2NH3(正反应为放热反应)的下列条件后,有关的叙述中错误的是( )
2NH3(正反应为放热反应)的下列条件后,有关的叙述中错误的是( )
A.加入催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.增大压强,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降低温度,v(正)、v(逆)都减小,且v(逆)减小的倍数大于v(正)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
查看答案和解析>>
科目: 来源: 题型:
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
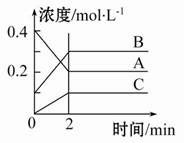
A.发生的反应可表示为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目: 来源: 题型:
已知Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+====I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·
cn(Fe3+)(k为常数)。
|
| c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 |
| ① | 0.20 | 0.80 | 0.032 k |
| ② | 0.60 | 0.40 | 0.144 k |
| ③ | 0.80 | 0.20 | 0.128 k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是( )
A.Fe3+浓度对正反应速率影响程度大于I-浓度的影响程度
B.Fe3+浓度对正反应速率影响程度小于I-浓度的影响程度
C.Fe3+浓度对正反应速率影响程度等于I-浓度的影响程度
D.无法比较
查看答案和解析>>
科目: 来源: 题型:
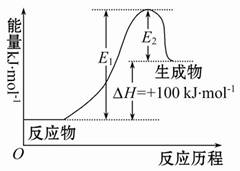
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com