
科目: 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
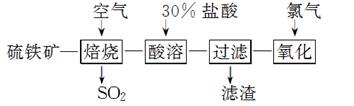
FeCl3·6H2O(晶体粗品)
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)??2SO3(g),该反应的平衡常数表达式为K=____;过量的SO2与NaOH溶液反应的化学方程式为________________________________________________________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________________________、________________________________________________________________________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________________;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为_______________________。
(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是____________________________ 。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO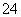 、Br-、HCO
、Br-、HCO 等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是______________________________________________。
②通入空气后,曝气池中的海水与天然海水相比,浓度有明显不同的离子是______(填字母)。
a.Cl- b.SO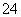 c.Br- d.HCO
c.Br- d.HCO
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)

①图中a极连接电源的______(填“正”或“负”)极,C口流出的物质是________。
②SO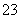 放电的电极反应为________________________。
放电的电极反应为________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释碱性增强的原因:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:
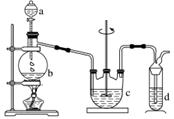
(1)b中反应的离子方程式为_______________________________________________________,
c中试剂为____________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d中的试剂为______________。
(4)实验中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
__________________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
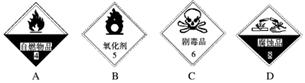
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。
(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:________________________________________________________。
实验结论:所得灰白色固体的化学式为__________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)_____________________________ _____________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是______________________________________。
方法二
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2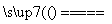 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是
①________________________________________________________________________;
②________________________________________________________________________。
方法三
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式_________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________________________________________________________________。
(2)实验过程中,装置B、C中发生的现象分别是____________________________________、______________________________________;
这些现象分别说明SO2具有的性质是________________和________________;装置B中发生反应的离子方程式为______________________________________________________
________________________________________________________________________。
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目: 来源: 题型:
右图表示某固态
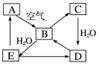
单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式:
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式:
________________________________________________________________________。
(3)写出一个由D生成B的化学方程式:
________________________________________________________________________。
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式:_______________________________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
对某酸性溶液(可能含有Br-、SO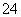 、H2SO3、NH
、H2SO3、NH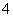 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO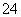 C.H2SO3 D.NH
C.H2SO3 D.NH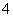
查看答案和解析>>
科目: 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计最严密的是( )
A.检验试液中的SO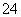 :试液
:试液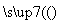 无沉淀
无沉淀 白色沉淀
白色沉淀
B.检验试液中的SO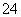 :试液
:试液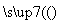 无沉淀
无沉淀 白色沉淀
白色沉淀
C.检验试液中的I-:试液 深黄色溶液
深黄色溶液 深黄色溶液
深黄色溶液
D.检验试液中的CO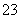 :试液
:试液 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解
查看答案和解析>>
科目: 来源: 题型:
硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(1)锌和稀H2SO4制H2________;
(2)浓硫酸作干燥剂________;
(3)浓硫酸与蔗糖的炭化实验(黑面包实验)________;
(4)实验室用乙醇和冰醋酸制取乙酸乙酯________;
(5)乙酸乙酯的水解________;
(6)纤维素的水解________;
(7)浓硫酸与铜的反应________;
(8)浓硫酸使湿润石蕊试纸变红,后来又变黑________。
查看答案和解析>>
科目: 来源: 题型:
以下每个选项中的两组物质都能反应,且能放出同一种气体的是( )
A.铜与稀硫酸,铜与浓硫酸
B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
D.硫化钠与稀硫酸,硫化钠与稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com