
科目: 来源: 题型:
下列有关说法正确的是( )
A.在饱和氯水中Cl-、NO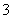 、Na+、SO
、Na+、SO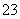 可以大量共存
可以大量共存
B.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
C.向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色说明原溶液中有I-
D.SO2通入碘水中,反应的离子方程式为SO2+I2+H2O===SO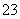 +2I-+2H+
+2I-+2H+
查看答案和解析>>
科目: 来源: 题型:
如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处干燥的红布条逐渐褪色。则D瓶中盛放的溶液不可能是( )
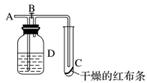
A.浓硫酸
B.NaOH溶液
C.饱和Na2SO3溶液
D.饱和氯化钠溶液
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水的 ④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目: 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免_________________。
(2)Br2可用热空气吹出,其原因是________________________________________。
(3)写出步骤③所发生的化学反应方程式___________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
________________________________________________________________________
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色,证明Br2的氧化性强于I2( )
(2014·四川理综,4C)
(2)制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体( )
(2014·天津理综,2B)
(3)碘是人体必需微量元素,所以要多吃富含高碘酸的食物( )
(2013·新课标全国卷I,7C)
(4)次氯酸钠溶液可用于环境的消毒杀菌( )
(2013·四川理综,1D)
(5)实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取( )
(2013·浙江理综,8A)
(6)从海水中提取物质都必须通过化学反应才能实现( )
(2013·福建理综,6B)
查看答案和解析>>
科目: 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是( )

A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)因漂白粉在空气中不稳定,故可用于漂白纸张(×)
(2014·江苏,4C)
(2)用惰性电极电解熔融NaCl:2Cl-+2H2O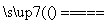 Cl2↑+H2↑+2OH-(×)
Cl2↑+H2↑+2OH-(×)
(2010·江苏,3A)
查看答案和解析>>
科目: 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:

回答下列问题:
(1)混合①中发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目: 来源: 题型:
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是( )
干海带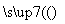 海带灰
海带灰 悬浊液
悬浊液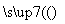 滤液
滤液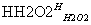 碘水
碘水 I2的CCl4溶液
I2的CCl4溶液 I2
I2
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com