
科目: 来源: 题型:
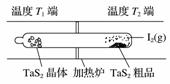
T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法中正确的是( )
A.0~t min内,v(I2)=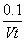 mol· L-1·min -1
mol· L-1·min -1
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为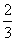
C.图中制备TaS2晶体过程中循环使用的物质是S2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1>T2
查看答案和解析>>
科目: 来源: 题型:
将2 mol X和2 mol Y充入2 L密闭容器中发生反应:X(g)+3Y(g)2Z(g)+aQ(g)。2 min时达到平衡,生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.8 mol·L-1
C.Y的转化率为60%
D.反应速率v(Y)=0.2 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
反应Fe(s)+CO2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=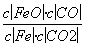
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g) ΔH>0,如果反应的平衡常数K值变大,则下列说法错误的是( )
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.改变的外界条件是升温
D.在平衡移动时逆反应速率先减小后增大
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=______。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目: 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________ mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
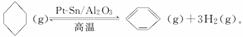 在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com