
科目: 来源: 题型:
下列说法中不正确的是( )
A.同族元素,随着电子层数的增加,I1逐渐增大
B.同周期元素,随着核电荷数的增加,I1逐渐增大
C.通常情况下,电离能I1<I2<I3
D.电离能越小,元素的金属性越强
查看答案和解析>>
科目: 来源: 题型:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是
C8H10(g)C8H8(g)+H2(g) ΔH=125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是____________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该反应是否达到了平衡状态?________(填“是”或“否”)。
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
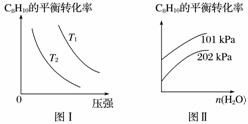
(4)由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________。该反应的Q______0(填“>”或“<”)。
(2)850 ℃时在体积为10 L的反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的物质的量浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____________。
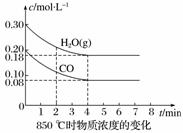
(3)若在500 ℃时进行。且CO、H2O(g)的起始浓度均为0.020 mol·L-1 ,该条件下,CO的最大转化率为 。
(4)若在850 ℃时进行,设起始时CO和H2O(g)共为1 mol,其中H2O(g)的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________。
查看答案和解析>>
科目: 来源: 题型:
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1 173K | ||
| ①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
完成下列填空:
(1)反应①为______(填“吸热”或“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)973 K时,若反应③在一个容积为2 L的反应容器内2 min时达到平衡,有3 mol电子发生转移,则在2 min内v(CO2)=____________。若压缩容器的容积为原来的一半,平衡将______移动(填“向左”、“向右”或“不”),CO2的浓度将______(填“增大”、“减小”或“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,反应:6H2(g)+2CO2(g)C2H5OH(g)+3H2O(g)的数据如下图所示。

下列说法正确的是( )
A.该反应的ΔH>0
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目: 来源: 题型:
在300 ℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)2NH3(g) ΔH<0的影响如图所示,下列说法正确的是( )
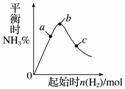
A.反应在b点达到平衡
B.b点H2的转化率最高
C.c点N2的转化率最高
D.a、b、c三点的平衡常数Kb>Ka>Kc
查看答案和解析>>
科目: 来源: 题型:
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3O2+[O] ΔH>0 平衡常数为K1;
反应② [O]+O32O2 ΔH<0 平衡常数为K2;
总反应: 2O33O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A.降低温度,K减小 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
查看答案和解析>>
科目: 来源: 题型:
已知A(g)+B(g)C(g)+D(g),反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830 ℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol·L-1·s-1。下列说法中正确的是( )
A.4 s时c(B)为0.76 mol·L-1
B.830 ℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1 200 ℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com