
科目: 来源: 题型:
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16 g B.32 g
C.64 g D.无法计算
★ ★★
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO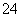 、NO
、NO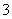
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO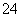
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
★ ★★
查看答案和解析>>
科目: 来源: 题型:
下列有关硝酸化学性质的叙述中,正确的是( )
A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色
B.硝酸能与FeO反应,只表现氧化性
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
★ ★★
查看答案和解析>>
科目: 来源: 题型:
答案 (1)1∶3
(2)①2NO2+2NaOH===NaNO3+NaNO2+H2O
②NaNO2
(3)①Na2CO3+2NO2===NaNO3+NaNO2+CO2
②NaNO3:0.05 mol NaNO2:0.15 mol 0.5
解析 (1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3: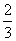 V(NO),处理NO2需NH3:
V(NO),处理NO2需NH3: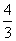 V(NO2),则
V(NO2),则
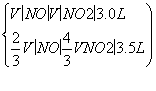
解得V(NO)=0.75 L
V(NO2)=2.25 L
V(NO)∶V(NO2)=1∶3。
(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。
②NO中氮的化合价为+2价,NO2中氮的化合物为+4价,二者1∶1混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
(3)②n(NO2)=0.15 mol,n(NO)=0.05 mol
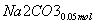 +
+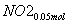 +
+ ===
===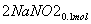 +CO2
+CO2
则单独与Na2CO3反应的NO2为0.15 mol-0.05 mol=0.1 mol
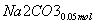 +
+ ===
===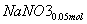 +
+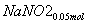 +CO2
+CO2
所以共生成NaNO3:0.05 mol,NaNO2:0.15 mol
c(Na2CO3)= =0.5 mol·L-1。
=0.5 mol·L-1。
★ ★★
查看答案和解析>>
科目: 来源: 题型:
答案 A
解析 本题考查氧化还原反应和阿伏加德罗定律及元素化合物知识,意在考查学生利用有关定律进行数据处理的能力。氮氧化合物与铜粉反应生成CuO和N2,结合题中气体体积和阿伏加德罗定律可推知该氮的氧化物分子中只含有一个氮原子,结合选项知A正确。
★ ★★
查看答案和解析>>
科目: 来源: 题型:
答案 A
解析 反应过程①+②得O2—→2O,③O+O2—→O3,NO2起催化剂作用,反应过程中NO2作氧化剂,A项正确,B、C项错误;O3与O2的相对分子质量不相同,不是同分异构体,属同素异形体,D项错误。
★ ★★
查看答案和解析>>
科目: 来源: 题型:
答案 由于NO2和Br2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。所以不能用淀粉KI试纸、pH试纸、NaOH溶液来鉴别,但二者性质又有差别,可以用下列方法鉴别:①AgNO3溶液;②CCl4溶液;③用水洗法。
★ ★★
查看答案和解析>>
科目: 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是_______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
★ ★★
查看答案和解析>>
科目: 来源: 题型:
O3能吸附有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V形,键角116.5°。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键:中间O原子提供2个电子,旁边两个O原子分别各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
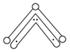
(1)题中非极性共价键是________键,特殊的化学键是________键(填“σ”或“π”)。
(2)1919年,Langmuir提出等电子体的概念:由短周期元素组成的粒子,只要其原子数相等,各原子外层电子数之和相等,也可互称为等电子体。等电子体的结构相似,物理性质相近,根据等电子原理:下列物质的分子与O3分子的结构最相似的是________(填字母)。
A.H2O B.CO2
C.SO2 D.BeCl2
(3)原子中没有跟其他原子共用的电子对叫孤电子对,那么O3分子有________对孤电子对。
(4)下列有关说法中正确的是________(填字母)。
A.臭氧和氧气互为同素异形体,它们在水中的溶解度相近
B.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
C.臭氧转化为氧气和氧气转化为臭氧均需要吸收能量
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com