
科目: 来源: 题型:
将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
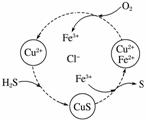
(1)在图示的转化中,化合价不变的元素是________。
(2)反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为______。
(3)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________________________________。
查看答案和解析>>
科目: 来源: 题型:
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目: 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
A.9.0 L B.13.5 L
C.15.7 L D.16.8 L
查看答案和解析>>
科目: 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
查看答案和解析>>
科目: 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中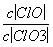 =
=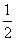
B.参加反应的氯气的物质的量等于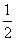 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: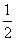 a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为  a mol
a mol
查看答案和解析>>
科目: 来源: 题型:
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO 等杂质。除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是________________________________________________________________________。
,其原因是________________________________________________________________________。
[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9]
②该法工艺原理如下图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。

工艺中可以利用的单质有________(填化学式),发生器中生成ClO2的化学方程式为________________________________________________________________________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
 __(D)__+24NaClO3+12H2SO4===
__(D)__+24NaClO3+12H2SO4=== ClO2↑+
ClO2↑+ CO2↑+18H2O+
CO2↑+18H2O+ ________
________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的________倍。
查看答案和解析>>
科目: 来源: 题型:
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KxCuy(C2O4)z·nH2O。通过下述实验确定该晶体的组成。(已知:MnO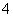 在酸性条件下,加热能分解为O2,同时生成Mn2+。)
在酸性条件下,加热能分解为O2,同时生成Mn2+。)
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO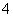 +5C2O
+5C2O +16H+===2Mn2++8H2O+10CO2↑。
+16H+===2Mn2++8H2O+10CO2↑。
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为I2+2S2O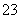 ===2I-+S4O
===2I-+S4O 。
。
(1)步骤b中生成白色沉淀的离子方程式:________________________________________________________________________。
(2)步骤b中“将溶液充分加热”的目的是________________________________________________________________________。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n(C2O )(写出计算过程)
)(写出计算过程)
________________________________________________________________________。
②计算样品中n(Cu2+)(写出计算过程)
________________________________________________________________________。
③根据________原理可求出n(K+),再依据________原理求得n(H2O)。
④该样品晶体的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
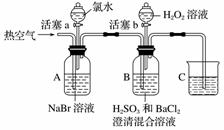
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加氯水, 关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是________________________________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________________________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是________________________________________________________________________。
(5)由上述实验得出的结论是________________________________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
查看答案和解析>>
科目: 来源: 题型:
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A.8.64 B.9.20
C.9.00 D.9.44
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com