
科目: 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式_____________________________________________。
②步骤4为加快过滤速度,常用_________________________________________________(填过滤方法)。
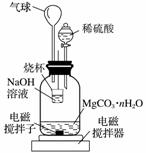
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入右图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是______________________________________________________
__________________________;
②上述反应后期要升温到30 ℃,主要目的是__________________________________;
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为________________________(用含a的表达式表示)。
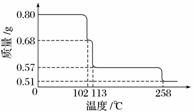
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。

查看答案和解析>>
科目: 来源: 题型:
在0 ℃、1.01×105 Pa时进行下列实验:甲、乙、丙三位同学各取30.0 mL同浓度的盐酸,加入相同组成的镁铝合金粉末,测定产生气体的体积,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
试求:(1)盐酸的物质的量浓度是多少?
(2)合金中各成分的质量分数。
查看答案和解析>>
科目: 来源: 题型:
现有一份CuO和Cu2O的混合物,用H2还原法测定其中的CuO质量x g,实验中可以测定以下数据:①W:混合物的质量(g)、②W(H2O):生成水的质量(g)、③W(Cu):生成 Cu的质量(g)、④V(H2):标准状况下消耗H2的体积(L)。
(已知摩尔质量:Cu:64 g·mol-1、CuO:80 g·mol-1、Cu2O:144 g·mol-1、H2O:18 g·mol-1)
(1)为了计算x至少需要测定上述4个数据中的____个,这几个数据的组合共有________种。请将这些组合一一填入下列空格中。
说明:①选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体算式。
②每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)从上述组合中选出一个含W数据的求x的计算式:
________________________________________________________________________。
(3)以上数据组合中易于取得的一组是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________
________________________________________________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目: 来源: 题型:
某样品是由碳酸钠与氯化钠组成的固体混合物,现欲测定样品中碳酸钠的质量分数。
某同学称取10.00 g样品,配成1 000 mL溶液,用______(填仪器名称)量取25.00 mL放入锥形瓶中,加入甲基橙作指示剂,用0.150 0 mol·L-1标准盐酸溶液滴定至终点,平行测定三次,有关实验数据记录如下表,则样品中碳酸钠的质量分数为__________。
| 实验编号 | 待测液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 25.00 | 0.00 | 30.02 |
| 2 | 25.00 | 0.20 | 33.80 |
| 3 | 25.00 | 1.40 | 31.38 |
查看答案和解析>>
科目: 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O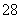 +2I-===2SO
+2I-===2SO +I2 (慢)
+I2 (慢)
I2+2S2O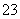 ===2I-+S4O
===2I-+S4O (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O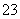 与S2O
与S2O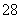 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O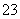 )∶n(S2O
)∶n(S2O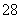 )________________。
)________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________,理由是_______________________________________
________________________________________________________________________。
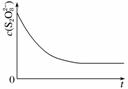
(3)已知某条件下,浓度c(S2O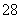 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O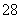 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
查看答案和解析>>
科目: 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测
氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_______________________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
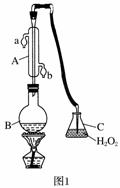

(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
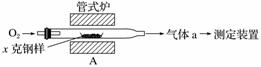
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2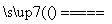
1________+3________。
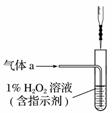
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
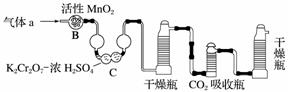
①气体a通过B和C的目的是__________________________________________。
②计算钢样中碳的质量分数,应测量的数据是________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式______________、______________。
(2)B2A2分子中存在_________个σ键,_________个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com