
科目: 来源: 题型:
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2 mol SO2、1 mol O2,达到平衡时放出热量为Q1 kJ,在同样条件下,向该容器中通入2 mol SO3,达到平衡时,吸收热量为Q2 kJ,则Q1和Q2的关系为______________。
查看答案和解析>>
科目: 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
查看答案和解析>>
科目: 来源: 题型:
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
| O===O(g) | H—H | H—O | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920 B.557
C.436 D.188
查看答案和解析>>
科目: 来源: 题型:
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
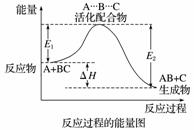
A.反应过程可表示为A+BC—→A…B…C—→AB+C
(反应物) (过渡态) (生成物)
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )
(2)物质发生化学变化都伴有能量的变化( )
(3)伴有能量变化的物质变化都是化学变化( )
(4)吸热反应在任何条件都不能发生( )
(5)Na转化为Na+时,吸收的能量就是该过程的反应热( )
(6)水蒸气变为液态水时放出的能量就是该变化的反应热( )
(7)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同( )
(8)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关( )
查看答案和解析>>
科目: 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:________________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为______________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有以下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
查看答案和解析>>
科目: 来源: 题型:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
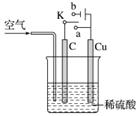
(1)甲同学认为在通入空气的同时,将开关K与______(填“a”或“b”)连接,即可实现。则此时石墨电极的反应式为__________________,电池的总反应式为________________________。电池工作时,H+向________(填“C”或“Cu”)极移动。
(2)乙同学认为,不通入空气,将K与______(填“a”或“b”)连接,也可以实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。若标准状况下产生2.24 L气体,则电路中转移的电子为______mol。
(3)丙同学认为还可以用如图所示装置模拟工业上电镀铜。他认为只要将C换成Fe(Cu足量),并将乙同学的实验持续足够长时间,即可实现在Fe上镀Cu。你认为他的想法______(填“正确”或“不正确”),理由是______________。这种方法得到的铜镀层______(填“牢固”或“不牢固”),理由是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com