
科目: 来源: 题型:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?______________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)S(s)+ O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)( )
O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)( )
(2)NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1(中和热) (ΔH的数值正确)( )
(3)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1( )
(4)燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1( )
(5)H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1( )
(6)葡萄糖的燃烧热是2 800 kJ·mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1( )
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1( )
(7)已知101 kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ·mol-1,则该反应的反应热为221 kJ·mol-1( )
(8)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量( )
(9)已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1( )
(10)CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1( )
(11)氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)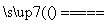 2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1( )
2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1( )
查看答案和解析>>
科目: 来源: 题型:
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )
A.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=+890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
科目: 来源: 题型:
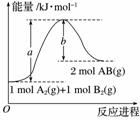
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com