
科目: 来源: 题型:
一定温度下,水存在H2OH++OH- ΔH>0的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
查看答案和解析>>
科目: 来源: 题型:
25 ℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
查看答案和解析>>
科目: 来源: 题型:
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
查看答案和解析>>
科目: 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=+179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:


①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
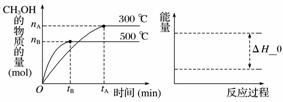
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
查看答案和解析>>
科目: 来源: 题型:
按要求回答下列问题
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______________________________________。
(2)已知:CH3OH(g)+ O2(g)??CO2(g)+2H2(g)
O2(g)??CO2(g)+2H2(g)
ΔH1=-192.9 kJ·mol-1
H2(g)+ O2(g)??H2O(g)
O2(g)??H2O(g)
ΔH2=-120.9 kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变ΔH3=__________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为
C6H5—CH2CH3(g)??C6H5—CH===CH2(g)+H2(g) ΔH1
已知:3C2H2(g)??C6H6(g) ΔH2
C6H6(g)+C2H4(g)??C6H5—CH2CH3(g) ΔH3
则反应3C2H2(g)+C2H4(g)??C6H5—CH===CH2(g)+H2(g)的ΔH=____________。
(4)氨的合成是最重要的化工生产之一。
工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)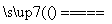 CO(g)+H2(g);
CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=____________。
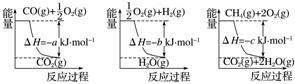
(5)甲醇是一种用途广泛的化工原料。
工业上常用下列两种反应制备甲醇:
①CO(g)+2H2(g)??CH3OH(g)
ΔH1=-90.1 kJ·mol-1
②CO2(g)+3H2(g)??CH3OH(g)+H2O(l) ΔH2
已知:CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
则ΔH2=__________。
查看答案和解析>>
科目: 来源: 题型:
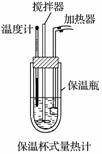
在量热计(如图)中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·K-1(已知CH3COOH电离要吸热)。
(1)CH3COOH的中和热ΔH=_____________________________________________。
(2)CH3COOH中和热的文献值为-56.1 kJ·mol-1,你认为造成(1)中测得的实验值有偏差的可能原因是_______________________________________________________________________。
(3)实验中NaOH溶液过量的目的是_______________________________________________。
(4)你认为CH3COOH的中和热与盐酸的中和热绝对值相比,__________的较大,其原因是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1②X(g)—→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是( )
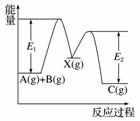
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1=-a kJ·mol-1,②2H2(g)+O2(g)===2H2O(l)
ΔH2=-b kJ·mol-1,则a>b
D.已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1,②C(金刚石,s)+O2(g)===
CO2(g) ΔH2=-395.0 kJ·mol-1,则金刚石比石墨稳定
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
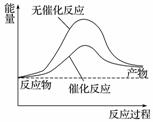
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: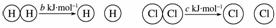
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 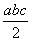 kJ
kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com