
科目: 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)铝罐可久盛食醋( )
(2014·福建理综,6C)
(2)氢氧化铝可作胃酸的中和剂( )
(2014·四川理综,1D)
(3)明矾用作净水剂不涉及化学变化( )
(2014·重庆理综,1A)
(4)铝与Fe2O3发生铝热反应,反应后固体物质增重( )
(2014·新课标全国卷Ⅱ,9C)
(5)AlCl3溶液中加入过量稀氨水:Al3++3NH3·H2O===Al(OH)3↓+4NH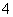 ( )
( )
(2014·四川理综,3C改编)
(6)Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O===2AlO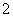 +3H2↑( )
+3H2↑( )
(2014·北京理综,9D)
(7)明矾溶液中滴入Ba(OH)2溶液使SO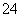 恰好完全沉淀:2Ba2++3OH-+Al3++2SO
恰好完全沉淀:2Ba2++3OH-+Al3++2SO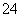 ===2BaSO4↓+Al(OH)3↓( )
===2BaSO4↓+Al(OH)3↓( )
(2013·大纲全国卷,11D)
查看答案和解析>>
科目: 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
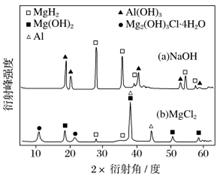
查看答案和解析>>
科目: 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
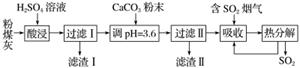
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
MgSO4·7H2O是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2杂质)制取MgSO4·7H2O的实验,流程如下。


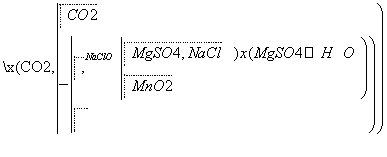
(1)第①步研磨的目的是____________________,所得滤液主要含__________________、__________________等溶质。
(2)第②步反应的离子方程式为_________________________________。
(3)第③步浓缩结晶后,要经过________、洗涤、干燥等步骤才可得到MgSO4·7H2O,洗涤沉淀的基本操作是____________________________________________。
(4)若制得MgSO4·7H2O质量为82.00 g,测得MnO2质量为1.74 g,且测得第①步滤渣质量为4.70 g,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中MgCO3的质量分数为____________________。
查看答案和解析>>
科目: 来源: 题型:
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
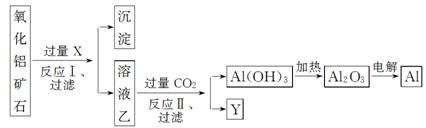
对上述流程中的判断正确的是( )
A.试剂X可以为氨水,沉淀中含有铁的化合物
B.CO2可以用H2SO4溶液或稀盐酸代替
C.反应Ⅱ中的反应为CO2+AlO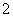 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO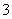
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
查看答案和解析>>
科目: 来源: 题型:
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:


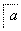

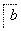 ,③
,③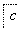 ,④
,④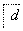 电解,
电解,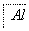
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目: 来源: 题型:
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO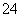 的物质的量之比为( )
的物质的量之比为( )
A.1∶3 B.2∶3 C.6∶1 D.3∶1
查看答案和解析>>
科目: 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
A.3 mL B.7.5 mL
C.15 mL D.17.5 mL
查看答案和解析>>
科目: 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
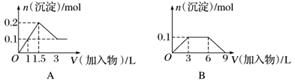
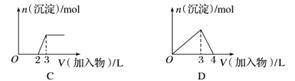
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目: 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO 的物质的量的变化
的物质的量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com