
科目: 来源: 题型:
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低
于16.2 ℃
查看答案和解析>>
科目: 来源: 题型:
已知热化学方程式:2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是 ( )。
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)
所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为
Q kJ
C.增大压强或升高温度,该反应过程放出更多的热量
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此
过程中有2 mol SO2(g)被氧化
查看答案和解析>>
科目: 来源: 题型:
已知下列热化学方程式:
①H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目: 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是 ( )。

A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________________________________________________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为________________________________________________________________________;
上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
下面是有关物质的转化关系图(有些物质已省略)。
若A为单质,E在常温下为液体,C的相对分子质量为78。请回答下列问题:

(1)画出A的原子结构示意图________,F的电子式是________。
(2)下面对C物质结构、性质的推断中,不正确的是________。
A.久置于空气中会变成白色
B.具有强氧化性
C.晶体中存在离子键和共价键
D.遇湿润的紫色石蕊试纸只能使其变蓝色
(3)若C是含氧化合物且氧为18O时,则C与D反应所得产物的摩尔质量分别为__________________。
查看答案和解析>>
科目: 来源: 题型:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:________________________________________________________________________________________________________________________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:_____________________________________________________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列图像中,纵坐标为沉淀量,横坐标为某溶液中加入的反应物的物质的量,选择合适图像对应的字母填空。

(1)AlCl3溶液中加入氨水至过量________。
(2)AlCl3溶液中加入NaOH溶液至过量________。
(3)AlCl3、MgCl2混合溶液中加入NaOH溶液至过量________。
(4)澄清石灰水中通入过量CO2________。
(5)含有少量盐酸的AlCl3溶液中加入过量NaOH溶液________;
(6)含有少量HCl的AlCl3溶液中加入过量氨水________。
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:
Al3++4NH3·H2O===AlO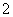 +4NH
+4NH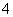 +2H2O
+2H2O
B.浓烧碱溶液中加入铝片:
Al+2OH-===AlO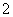 +H2↑
+H2↑
C.用浓NaOH溶液溶解Al2O3:
2OH-+Al2O3===2AlO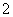 +H2O
+H2O
D.往碳酸镁中滴加稀盐酸:
CO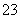 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com