
科目: 来源: 题型:
判断下列说法是否正确,正确的划“√”,错误的划“×”
(1)氢键是氢元素与其他元素形成的化学键( )
(2)可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键( )
(3)乙醇分子和水分子间只存在范德华力( )
(4)碘化氢的沸点高于氯化氢的沸点是因为碘化氢分子间存在氢键( )
(5)水分子间既存在范德华力,又存在氢键( )
(6)氢键具有方向性和饱和性( )
(7)H2和O2之间存在氢键( )
(8)H2O2分子间存在氢键( )
(9)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )
(10)氢键的存在一定能使物质的熔、沸点升高( )
(11)极性分子中可能含有非极性键( )
(12)H2O比H2S稳定是因为水分子间存在氢键( )
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________________________________。
(2)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为___________________________________________。
(3)胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
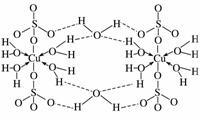
下列有关胆矾的说法正确的是________。
A.所有氧原子都采取sp3杂化
B.氧原子存在配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1
D.胆矾中的水在不同温度下会分步失去
Ⅱ.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3 的个数比配合,还可以其他个数比配合。请按要求填空:
(1)若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显血红色。该离子的离子符号是__________。
(2)若Fe3+与SCN-以个数比1∶5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。请回答下列问题:
(1)BF3分子的立体结构为______________,NF3分子的立体结构为____________。
(2)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取sp杂化的分子是____________(写结构简式,下同),采取sp2杂化的分子是__________,采取sp3杂化的分子是____________。试写出一种有机物分子的结构简式,要求同时含有三种不同杂化方式的碳原子:________________________________________________________________________。
(3)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,请分析可能的原因是________________________________________________。
(4)由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越多,阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。由此可知,四种卤化银(AgF、AgCl、AgBr和AgI)在水中的溶解度由大到小的顺序为________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
C.H2SO4分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有1个σ键、2个π键
查看答案和解析>>
科目: 来源: 题型:
1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是________和________;________和
________________________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO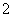 互为等电子体的分子有________、________。
互为等电子体的分子有________、________。
查看答案和解析>>
科目: 来源: 题型:
NH3 分子的空间构型是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是 ( )
A.NH3分子是极性分子
B.分子内3个N—H键的键长相等,键角相等
C.NH3分子内3个N—H键的键长相等,3个键角都等于107°
D.NH3分子内3个N—H键的键长相等,3个键角都等于120°
查看答案和解析>>
科目: 来源: 题型:
结合事实判断CO和N2相对更活泼的是____________,试用下表中的键能数据解释其相对更活泼的原因:____________________。
| CO | C—O | C===O | C≡O |
| 键能(kJ·mol-1) | 357.7 | 798.9 | 1 071.9 |
| N2 | N—N | N===N | N≡N |
| 键能(kJ·mol-1) | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目: 来源: 题型:
在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤H2O2、⑥NH4Cl、⑦NaOH、⑧Ar、⑨CO2、⑩C2H4
(1)只存在非极性键的分子是__________;既存在非极性键又存在极性键的分子是__________;只存在极性键的分子是__________。
(2)只存在单键的分子是__________,存在三键的分子是__________,只存在双键的分子是__________,既存在单键又存在双键的分子是__________。
(3)只存在σ键的分子是__________,既存在σ键又存在π键的分子是__________。
(4)不存在化学键的是__________。
(5)既存在离子键又存在极性键的是__________;既存在离子键又存在非极性键的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com