
科目: 来源: 题型:
原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
(1)请按要求任意写一个相应物质:(填化学式)
含有非极性键的离子化合物________,既含有非极性键又含极性键的非极性分子________,既含有非极性键又含极性键的极性分子________,全部由非金属元素组成的离子化合物________,由金属元素和非金属元素组成的共价化合物________。
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图1所示。

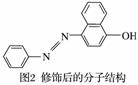
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会________(填“增大”或“减小”),原因是______________。
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
(4)右图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是______;表示ⅣA族元素氢化物沸点的曲线是______;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是________________________________________________________________________;
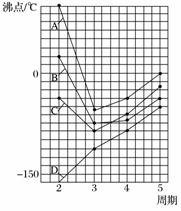
A、B、C曲线中第2周期元素的氢化物的沸点显著高于第3周期元素的氢化物的沸点,其原因是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:________________________________________________________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目: 来源: 题型:
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚。甲醚是乙醇的同分异构体,其熔点为-141.5 ℃,沸点为-24.9 ℃,在加热条件下可分解成甲烷、乙烷、甲醛等。
(1)乙醇的沸点比甲醚高,其主要原因是________________________________________________________________________。
(2)甲醛分子中碳原子轨道的杂化类型为________________________________________________________________________。
(3)储氢材料化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会缓慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为______________(若含有配位键,要求用箭头表示),1 mol化合物B中σ键的数目是________________。
查看答案和解析>>
科目: 来源: 题型:
O3能吸附有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V形,键角116.5°。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键:中间O原子提供2个电子,旁边两个O原子分别各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:

(1)题中非极性共价键是________键,特殊的化学键是________键(填“σ”或“π”)。
(2)1919年,Langmuir提出等电子体的概念:由短周期元素组成的粒子,只要其原子数相等,各原子外层电子数之和相等,也可互称为等电子体。等电子体的结构相似,物理性质相近,根据等电子原理:下列物质的分子与O3分子的结构最相似的是________(填字母)。
A.H2O B.CO2
C.SO2 D.BeCl2
(3)原子中没有跟其他原子共用的电子对叫孤电子对,那么O3分子有________对孤电子对。
(4)下列有关说法中正确的是________(填字母)。
A.臭氧和氧气互为同素异形体,它们在水中的溶解度相近
B.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
C.臭氧转化为氧气和氧气转化为臭氧均需要吸收能量
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为__________________________________________________。
(2)XZ2与YZ2分子的立体结构分别是____________________________________
和________________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是________________________________________________________________________。
(3)Q的元素符号是__________,它的基态原子的核外电子排布式为______________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键__________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列物质中不存在氢键的是 ( )
A.冰醋酸中醋酸分子之间
B.液态氟化氢中氟化氢分子之间
C.一水合氨分子中的氨分子与水分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
查看答案和解析>>
科目: 来源: 题型:
以下微粒含配位键的是 ( )
①N2H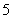 ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH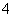 ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
查看答案和解析>>
科目: 来源: 题型:
下列有关σ键的说法错误的是 ( )
A.如果电子云图像是由两个s电子重叠形成的,即形成ss σ键
B.s电子与p电子形成sp σ键
C.p和p不能形成σ键
D.HCl分子里含有一个sp σ键
查看答案和解析>>
科目: 来源: 题型:
有关物质结构的下列说法中正确的是( )
A.碘升华时破坏了共价键
B.含极性键的共价化合物一定是电解质
C.氯化钠固体中的离子键在溶于水时被破坏
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com