
科目: 来源: 题型:
已知正己烷的球棍模型为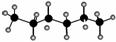 。某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是 ( )。
。某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是 ( )。
A.a分子中可能有三个甲基
B.a的分子式为C6H10
C.a的一氯代物可能有三种
D.在光照条件下,a能与溴的四氯化碳溶液发生取代反应
查看答案和解析>>
科目: 来源: 题型:
下列关于碳氢化合物的叙述正确的是 ( )。
A.碳氢化合物的通式为CnH2n+2
B.燃烧产物为二氧化碳和水的化合物一定是碳氢化合物
C.碳原子间以单键相连的烃是烷烃
D.碳氢化合物分子的相对分子质量一定是偶数
查看答案和解析>>
科目: 来源: 题型:
下列化学用语表示正确的是( )
①甲基的电子式: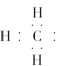
②乙炔的最简式:C2H2
③蔗糖的分子式:C12H22O11
④乙醛的结构简式:CH3COH
⑤苯分子的比例模型: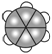
A.①②④ B.③⑤
C.②③⑤ D.④⑤
查看答案和解析>>
科目: 来源: 题型:
下列有关说法不正确的是 ( )。
A.天然气的主要成分为CH4
B.1 mol Cl2与1 mol CH4恰好完全反应,则转移的电子总数为2 NA
C.已知CH4+H2O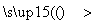 CH3OH+H2该反应的有机产物是无毒物质
CH3OH+H2该反应的有机产物是无毒物质
D.CH4的二氯代物只有一种,此事实可说明CH4为正四面体结构
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是____________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:______________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
①实验Ⅰ的现象为________________________________________________________________________。
②FeCl2溶液与新制氯水反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL | |
| 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:________________________________________________________________________。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL0.1 mol·L-1 FeCl3溶液,__________ |
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红的原因,认为Fe3+与I-反应的离子方程式应写为________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
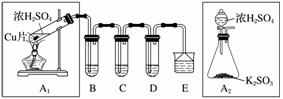
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为__________,C中反应的离子方程式为________________________________________________________________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是________________________________________________________________________
(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO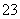 、SO
、SO 、HSO
、HSO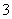 等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO
等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO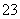 和HSO
和HSO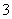 ,完成下表的实验操作、预期现象和结论:
,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1 mol·L-1 BaCl2溶液滴入小烧杯中直至过量 | 若出现白色浑浊,则溶液中存在SO |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______________ | |
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com