
科目: 来源: 题型:
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
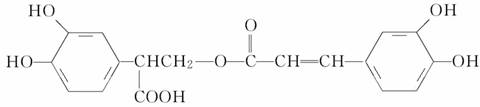 ,以邻苯二酚为原料合成迷迭香酸的路线为
,以邻苯二酚为原料合成迷迭香酸的路线为
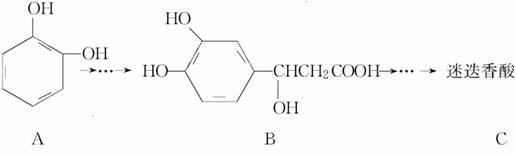
下列说法正确的是
A. 有机物B可以发生取代、加成、消去、氧化反应
B. 有机物A分子中所有原子一定在同一平面上
C. 有机物C在浓硫酸催化下水解的一种产物是B
D. 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)  N2O4(g) ΔH<0]
N2O4(g) ΔH<0]
| 容器 | 物质 | 起始浓度/(mol·L-1) | 平衡浓度/(mol·L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目: 来源: 题型:
综合下图判断,下列叙述不正确的是
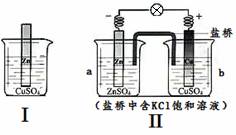
A. Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B.标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
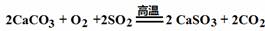
| |
查看答案和解析>>
科目: 来源: 题型:
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
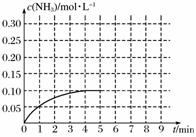
(1)该反应的化学平衡常数表达式为_______________________________。
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为__________________。
(3)判断该反应达到平衡状态的标志是________(填序号)。
①N2和NH3浓度相等 ②NH3百分含量保持不变 ③容器中气体的压强不变 ④NH3的生成速率与H2的消耗速率相等 ⑤容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1
④0.08 mol·L-1
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末至达到新平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目: 来源: 题型:
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
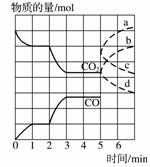
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=__________。
(2)反应进行至2 min时,若升高温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH______0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写字母)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是__________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知反应:2CH3OH(g)CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。在此温度下,向密闭容器中加入一定量CH3OH,反应到5 min时测得各组分的浓度如表所示:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
(1)该反应在低温下(此时水为液态)能自发进行,则该反应的ΔH______0(填“>”、“<”或“=”,下同)。
(2)比较此时正、逆反应速率的大小:v正______v逆。
(3)前5 min时,用CH3OCH3表示该反应的速率为________________。
(4)再过一段时间后,反应达到平衡状态。能判断该反应已达到化学平衡状态的依据是__________(填字母)。
A.容器中压强不变
B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O)
D.c(CH3OCH3)=c(H2O)
(5)达到平衡状态时,CH3OH的转化率为__________。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g)
ΔH=148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是__________(填字母)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:__________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填字母)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com