
科目: 来源: 题型:
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
| 方案 | 现象或产物 |
| |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 | ||
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )。
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目: 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目: 来源: 题型:
下列有关金属的说法中,不正确的是( )
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目: 来源: 题型:
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是 ( )。
A.这里的“另一种反应物”具有还原性
B.CuH可作氧化剂、还原剂
C.CuH+Cl2===CuCl+HCl(燃烧)
D.CuH+HCl===CuCl+H2↑(常温)
查看答案和解析>>
科目: 来源: 题型:
合金比纯金属制成的金属材料的优点是 ( )。
①合金的硬度一般比它的各成分金属的大 ②一般地,合金的熔点比它的各成分金属的更低 ③改变原料的配比、改变生成合金的条件,得到有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
下列关于金属元素的叙述正确的是( )
A.金属元素的单质只有还原性,其离子只有氧化性
B.金属元素的单质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.大多数金属元素的单质为电的良导体
查看答案和解析>>
科目: 来源: 题型:
丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=+32.4 kJ·mol-1
CH(g ) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池负极反应式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)= 。
②c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
查看答案和解析>>
科目: 来源: 题型:
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
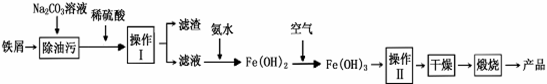 |
回答下列问题:
①操作II所包含的两项主要基本操作是 。 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为 。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式: 。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为: ,该滴定过程中 (填“是”或“否”)还需要指示剂。
实验步骤如下:
a. 考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加 溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c. 量取25.00mL待测溶液于锥形瓶中;
d. 用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
② 某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系
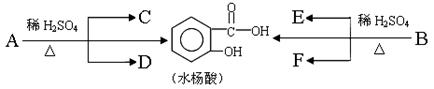 |
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a. C3H6O3 b. C3H8O c. C2H4 d. C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:_________________________________; 一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式:________________________________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
① 与A互为同分异构体 ② 可以水解
③ 苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____; 由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式:_________________________________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:_________________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是____________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com