
科目: 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
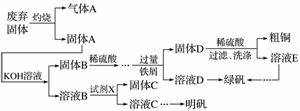
(1)试剂X是________(写化学式)。
(2)配平下列方程式:
MnO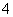 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO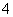 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________(填仪器名称)中。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:_______________________________________。
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
 Fe3++
Fe3++ SO
SO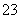 +
+ ________—→
________—→ Fe2++
Fe2++ ________+
________+ ________
________
 乙同学查阅资料得知:
乙同学查阅资料得知:
ⅰ.Fe2+与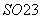 反应生成墨绿色的絮状沉淀FeSO3;
反应生成墨绿色的絮状沉淀FeSO3;
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤Ⅰ中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是______________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液
b.KSCN溶液
c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:________________________________________________________________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目: 来源: 题型:
(1)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
化学镀镍的溶液中含有Ni2+和H2PO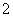 ,在酸性条件下发生以下镀镍反应:
,在酸性条件下发生以下镀镍反应:
Ni2++____H2PO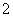 +__________—→____Ni+____H2PO
+__________—→____Ni+____H2PO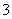 +__________
+__________
①请配平上述化学方程式。
②上述反应中,若生成1 mol H2PO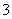 ,反应中转移电子的物质的量为________。
,反应中转移电子的物质的量为________。
(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2 mol Na2FeO4,则反应中电子转移的物质的量为________mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾________ L。
(3)S2O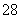 具有强氧化性,其还原产物为SO
具有强氧化性,其还原产物为SO ,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
(4)①在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
FeSO4+____KNO3+____H2SO4—→____K2SO4+____Fe2(SO4)3+____NO↑+____H2O;其中氧化剂为__________。
②铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2+HCl—→ClO2↑+________(没有配平)
(1)上述方程式中,缺项物质是________,配平方程式,并在下面补全反应物系数。
 NaClO2+
NaClO2+ HCl—→
HCl—→
(2)该反应中氧化剂和还原剂的物质的量之比是________________________。
生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________ mol。
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL (标准状况下)Cl2完全转化为Cl-,则S2O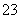 将转化为( )
将转化为( )
A.S2- B.S C.SO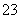 D.SO
D.SO
查看答案和解析>>
科目: 来源: 题型:
0.02 mol KMnO4固体加热一段时间后,收集到a mol甲气体,在反应后的残留固体中加入足量的浓盐酸,继续加热,又收集到b mol乙气体,设此时Mn元素全部以Mn2+存在于溶液中,则下列说法正确的是( )
A.甲、乙均为无色无味的气体
B.a的最大值为0.02
C.b的最小值为0.01
D.a+b的最小值为0.04
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com