
科目: 来源: 题型:
已知XY2是红棕色气体,Z基态原子的M层与K层电子数相等。Y基态原子的电子排布式是__________________________;Z所在周期中第一电离能最大的主族元素是_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
Na位于元素周期表第____周期第____族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
Cu+基态核外电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________。
查看答案和解析>>
科目: 来源: 题型:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
四种元素中的第一电离能最小的是__________,电负性最大的是__________。(填元素符号)
查看答案和解析>>
科目: 来源: 题型:
根据信息回答下列问题:
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
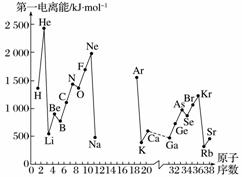
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第3周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是第________周期第________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是_________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com