
科目: 来源: 题型:
已知:
①H2(g)+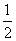 O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+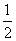 O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH3=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目: 来源: 题型:
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+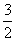 O2(g)===CO2(g)+2H2O(l)
O2(g)===CO2(g)+2H2O(l)
ΔH=725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=1 451.52 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: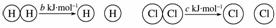
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ
查看答案和解析>>
科目: 来源: 题型:
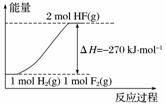
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用右图来表示
查看答案和解析>>
科目: 来源: 题型:
下列推论正确的是( )
A.S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2
B.C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ·mol-1,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则:含20 g NaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热等于110.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+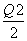 ) kJ
) kJ
D.M(g)+N(g)R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物质能属于新能源
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目: 来源: 题型:
完成下列小题。
(1)[2013·江苏,20(1)]白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+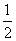 O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+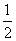 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
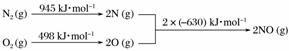
写出该反应的热化学方程式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________。
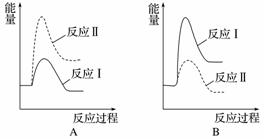
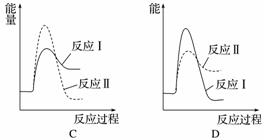
(2)[2014·浙江理综,27(3)]煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)
ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
(3)[2014·广东理综,31(1)]用CaSO4代替O2与燃料CO反应,既可提高燃料效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=__________(用ΔH1、ΔH2和ΔH3表示)。
(4)[2014·大纲全国卷,28(1)]化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________。
(5)[2014·天津理综,7(4)]晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
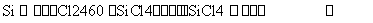
写出SiCl4的电子式:______;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com