
科目: 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C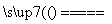 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2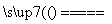 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C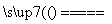 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde C.cde D.ab
查看答案和解析>>
科目: 来源: 题型:
下列关于SiO2和CO2的说法中正确的是( )
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.CO2和SiO2与水反应分别生成相应的酸
C.CO2是酸性氧化物,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子组成的
查看答案和解析>>
科目: 来源: 题型:
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入下表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气
D.水 E.二氧化碳
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤
⑤结晶
| 粉末状混合物 | 选择的试剂 | 选用的操作 | |
| (1) | CaCO3(SiO2) | ||
| (2) | NaCl(SiO2) | ||
| (3) | SiO2(Fe2O3) | ||
| (4) | SiO2(CaCO3) | ||
| (5) | SiO2(NH4Cl) |
查看答案和解析>>
科目: 来源: 题型:
写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法:
(1)CO(CO2):________________________________________________________________。
(2)CO2(CO):_________________________________________________________________。
(3)CO2(O2):__________________________________________________________________。
(4)CO2(SO2):_________________________________________________________________。
(5)CO2(HCl):__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O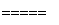 CO+H2+O2
CO+H2+O2
已知:

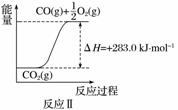
①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

查看答案和解析>>
科目: 来源: 题型:
按要求回答下列问题
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______________________________。
(2)已知:CH3OH(g)+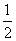 O2(g)CO2(g)+2H2(g)
O2(g)CO2(g)+2H2(g)
ΔH1=-192.9 kJ·mol-1
H2(g)+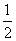 O2(g)H2O(g)
O2(g)H2O(g)
ΔH2=-120.9 kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变ΔH3=__________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为
C6H5—CH2CH3(g)C6H5—CH===CH2(g)+H2(g) ΔH1
已知:3C2H2(g)C6H6(g) ΔH2
C6H6(g)+C2H4(g)C6H5—CH2CH3(g) ΔH3
则反应3C2H2(g)+C2H4(g)C6H5—CH===CH2(g)+H2(g)的ΔH=____________。
(4)氨的合成是最重要的化工生产之一。
工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)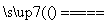 CO(g)+H2(g);
CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)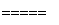 CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=____________。
(5)甲醇是一种用途广泛的化工原料。
工业上常用下列两种反应制备甲醇:
①CO(g)+2H2(g)CH3OH(g)
ΔH1=-90.1 kJ·mol-1
②CO2(g)+3H2(g)CH3OH(g)+H2O(l) ΔH2
已知:CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
H2O(l)===H2O(g) ΔH4=44.0 kJ·mol-1
则ΔH2=__________。
查看答案和解析>>
科目: 来源: 题型:
在量热计(如图)中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·K-1(已知CH3COOH电离要吸热)。

(1)CH3COOH的中和热ΔH=____________________________________________。
(2)CH3COOH中和热的文献值为-56.1 kJ·mol-1,你认为造成(1)中测得的实验值有偏差的可能原因是__________________________________________________。
(3)实验中NaOH溶液过量的目的是__________________________。
(4)你认为CH3COOH的中和热与盐酸的中和热绝对值相比,__________的较大,其原因是________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1②X(g)—→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是( )
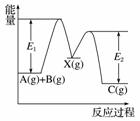
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目: 来源: 题型:
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
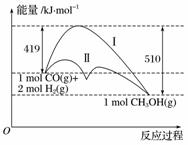
A.该反应的ΔH=91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com